
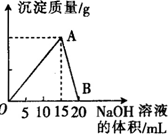
 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:分析 开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;
随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
(1)由于A→B消耗的氢氧化钠溶液体积为5ml,消耗NaOH为0.005L×2mol/L=0.01 mol,根据方程式可知n[Al(OH)3]=0.01mol,根据m=nM计算氢氧化铝的质量;(2)根据铝原子守恒则n(AlCl3)=0.01 mol,根据c=$\frac{n}{V}$计算氯化铝的物质的量浓度;
(3)生成氢氧化铝的最大量为0.01mol,0.234g氢氧化铝的物质的量为$\frac{0.234g}{78g/mol}$=0.003mol,则生成0.003mol氢氧化铝沉淀消耗氢氧化钠溶液体积有两种1情况,通过讨论法分别计算出消耗氢氧化钠溶液的体积.
解答 解:(1)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,
由于A→B消耗的氢氧化钠溶液体积为5ml,消耗NaOH为0.005L×2mol/L=0.01 mol,根据方程式可知n[Al(OH)3]=0.01mol,氢氧化铝的质量为:0.01mol×78g/mol=0.78g,
故答案为:0.78;
(2)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,
故氯化铝的物质的量浓度为:$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:0.5mol/L;
(3)0.234 g Al(OH)3的物质的量为:$\frac{0.234g}{78g/mol}$=0.003mol.
当NaOH溶液不足时,生成0.234g Al(OH)3所需NaOH的物质的量为0.003mol×3=0.009 mol,需要NaOH溶液的体积=$\frac{0.009mol}{2mol/L}$=0.0045L=4.5mL;
当NaOH溶液过量时,还剩余0.003molAl(OH)3,说明溶解的氢氧化铝的物质的量为:0.01mol-0.003mol=0.007mol,
溶解0.007mol Al(OH)3溶解消耗0.007molNaOH,0.01mol氯化铝完全转化成氢氧化铝需要消耗0.01mol×3=0.03mol氢氧化钠,
所以生成0.03mol氢氧化铝总共消耗NaOH的物质的量为:0.03+0.007mol=0.037mol,
需要NaOH溶液的体积=$\frac{0.037mol}{2mol/L}$=0.0185L=18.5mL,
故答案为:4.5;18.5.
点评 本题是AlCl3与NaOH反应与图象相结合的计算问题,题目难度中等,明确NaOH溶液逐滴加入到AlCl3溶液中的反应现象为解答关键,试题培养了学生对图象的解读能力、分析问题能力及化学计算能力等.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
 为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.
为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
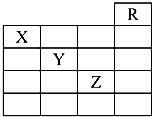 如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述中,正确的个数是( )| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和强度均高于铁合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
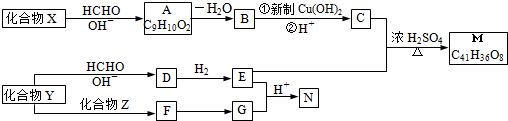
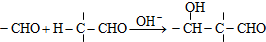
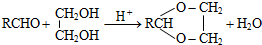
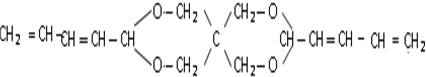
 Z:CH2=CHCHO E:
Z:CH2=CHCHO E:
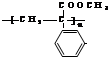 .
.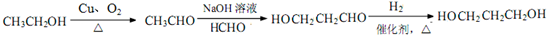
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com