
| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
分析 A.根据溶解度判断沉淀的先后顺序,利用溶度积常数计算出各离子浓度;结合反应的程度比较溶液离子浓度的大小;
B.依据碘化银和氯化银溶度积比较溶解度可知,碘化银溶解度小,反应中先析出碘化银;
C.AgCl饱和溶液中c(Ag+)为1.30×10-5mol•L-1.溶液中存在沉淀溶解平衡AgCl(s)?Ag++Cl-,氯离子浓度为1.30×10-5mol•L-1;依据Ksp=[Ag+][Cl-]计算得到;
D.依据氯化银和碘化银的溶度积比较溶解度,反应向更难溶的方向进行.
解答 解:A.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,反应后剩余n(Ag+)=0.003L×0.01mol/L=3×10-5mol,继续生成AgCl沉淀,反应后剩余氯离子的物质的量为:n(Cl-)=0.005×0.01mol/L-3×10-5mol=2×10-5mol,
c(Cl-)=2×10-5mol÷0.013L=1.53×10-3mol/L,
浊液中c(Ag+)=$\frac{1.30×1{0}^{-5}×1.30×1{0}^{-5}}{1.53×1{0}^{-3}}$mol/L=1.1×10-7mol/L,
c(I-)=$\frac{1.22×1{0}^{-8}×1.22×1{0}^{-8}}{1.1×1{0}^{-7}}$mol/L=1.35×10-9mol/L,
c(NO3-)=$\frac{0.01mol/L×0.008L}{0.013L}$=0.006mol/L,故c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故A错误;
B.碘化银的溶度积较小,则溶液中先产生的是AgI沉淀,故B正确;
C.AgCl饱和溶液中c(Ag+)为1.30×10-5mol•L-1,溶液中存在沉淀溶解平衡AgCl(s)?Ag++Cl-,氯离子浓度为1.30×10-5mol•L-1,由Ksp=[Ag+][Cl-]=1.30×10-5mol/L×1.30×10-5mol/L=1.69×10-10,故C正确;
D.碘化银比氯化银更难溶,则在AgCl悬浊液中滴加KI溶液,白色的氯化银沉淀会转变成黄色的碘化银沉淀,故D正确;
故选A.
点评 本题考查了难溶物的沉淀溶解平衡的计算及判断,题目难度中等,根据溶度积计算混合溶液中离子浓度是解题关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
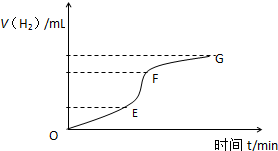 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B可形成AB32-、A2B42-等离子 | |
| B. | B的氢化物的沸点低于C的氢化物的沸点 | |
| C. | 单质C的晶体中含有共价键和范德华力 | |
| D. | 由A、D形成的一种物质可用以提取碘水中碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物一定不含共价键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 气态单质的分子中一定存在共价键 | |
| D. | 非金属元素的化合物一定不含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com