
|
下列分子中所有原子都满足最外层为8电子结构的是 | |
| [ ] | |
A. |
BF3 |
B. |
H2O |
C. |
SiCl4 |
D. |
PCl5 |
|
判断原子是否满足8电子结构的关键是要知道化合物结构,通过结构式,弄清该原子的成键数,从而判断化合物中原子最外层电子数.计算方法是:化合物中该原子最外层电子数=未成键时原子的最外层电子数+该原子成键形成共价键数(或化合价绝对值).该题各选项中,F、O、Cl都达到最低负价,都达到8电子结构,而A选项中的B有3个共价键(或化合价为+3),所以化合物BF3中B的最外层电子数为6个,B选项H2O中H最外层达到2电子.C选项SiCl4中Si有4个共价键,达到8电子,而D选项中P形成5个共价键,化合物中P在此化合物中最外层有5+5=10个电子.该类问题难点是对一些陌生的物质不能判断出元素化合价,弄不清该原子成键形成共价键数而出错.或受CO2、SiCl4等的影响而误认为成键原子的最高价态才达到8电子稳定结构,从而错选SF6、PCl5等. |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
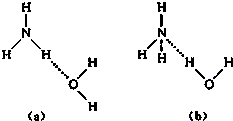 完成下列各题
完成下列各题 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com