
| A. | CH3-CH═CH2与C2H4 | B. | CH3COOCH3与CH3CH2COOCH3 | ||
| C. | 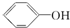 与 与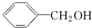 | D. | CH3CH2Cl与CH3CHClCH3 |
分析 同系物是指结构相似,分子组成相差1个或n个CH2的化合物,同系物的判断可以根据“两同一差”原则,即同通式同结构组成差n个CH2,互为同系物的化合物满足:1)必符合同一通式 2)必为同类物质 3)组成元素相同 4)结构相似但不一定相同 5)分子式不同,据此进行判断.
解答 解:A.均为烯烃,则CH3-CH═CH2与C2H4之间一定互为同系物,故A错误;
B.CH3COOCH3与CH3CH2COOCH3都属于酯类,二者结构相似,分子间相差1个CH2,二者互为同系物,故B错误;
C. 为苯酚,而
为苯酚,而 为苯甲醇,二者含有的官能团不同,则二者不属于同系物,故C正确;
为苯甲醇,二者含有的官能团不同,则二者不属于同系物,故C正确;
D.CH3CH2Cl与CH3CHClCH3都是一氯代烷,二者结构相似,分子间相差1个CH2,所以二者互为同系物,故D错误;
故选C.
点评 本题考查了同系物的判断,题目难度不大,该题侧重对学生基础知识的检验,同时兼顾对学生能力的培养,意在培养学生灵活运用基础知识解决实际问题的能力,该题的关键是明确同系物的含义和判断依据,然后灵活运用即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油分馏的各馏分均是纯净物 | |
| B. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| C. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| D. | 溴乙烷与NaOH水溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 | ||
| C. | 平衡时C的转化率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15:8:1 | B. | 13:6:1 | C. | 9:6:1 | D. | 6:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com