
25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3) 0.1 mol/L
0.1 mol/L
B
【解析】
试题分析:A.酸越弱,其酸根离子水解程度就越大,溶液的碱性就越强。由于0.1mol0.1mol/L NaF溶液的pH=8.1,NaHCO3溶液的pH=8.4,所以酸性HF> H2CO3,正确;B.NaCl是强酸强碱盐,盐电离产生的离子不能发生水解反应,所以对水的电离平衡不产生影响,CH3COONH4是弱酸弱碱盐,盐电离产生的阳离子和阴离子都发生水解反应,消耗水电离产生的H+、OH-,促进水的电离,使水的电离程度增大,所以由水电离产生的c(H+):①<②,错误;C.NaCl是强酸强碱盐,不发生水解,根据电荷守恒可得c(Na+)+c(H+)=c(Cl-)+c(OH-),而NaF是强碱弱酸盐,F-发生水解反应消耗,所以c(Cl-)>c(F-),F-发生水解反应消耗水电离产生的H+,使溶液显碱性,所以c(H+)前者大于后者,因此离子总浓度:前者大于后者,①>③,正确;D.④溶液中,根据物料守恒可得:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1 mol/L,正确。
考点:考查盐水解平衡常数的应用、盐溶液对水电离平衡的影响、溶液中离子定向比较的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:填空题
(9分)近期“五水共治”越来越引起人们的重视。对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。

①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。

①阳极的电极反应式为 ;
②简述浓缩室中得到浓乳酸的原理 ;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90g/ mol )。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:实验题
(15分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。

其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
向100mL 0.1mol? L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol ·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如右图所示。下列叙述正确的是
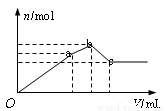
A.a点的沉淀总物质的量为0.03mol
B.oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-= 2BaSO4↓+Al(OH)3↓;
C.ab段发生反应的离子方程式是:2NH4++SO42-+Ba2++2OH-=2NH3?H2O+ BaSO4↓
D.反应到c点时,加入Ba(OH)2溶液的总体积为250mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
已知:H2(g) + Br2(g) → 2HBr(g) ΔH= —72 kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:则上述表格中的a值为
一定状态的分子 | H2(g) | Br2(l) | HBr(g) |
1 mol该分子中的化学键断裂吸收的能量/kJ | 436 | a | 369 |
A.404 B.344 C.260 D.200
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
具有防腐作用的甲醛
A.分子中共有12个电子 B.能发生加聚反应
C.难溶于水易溶于酒精 D.比例模型为:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:填空题
(12分)某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子是___________。
(2)沉淀G的化学式为_____________。
(3)①中生成A的离子方程式____________________。
(4)过滤操作中所使用到的玻璃仪器的名称为____________________。
(5)简述实验室检验气体F的方法 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13,X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
A.由X 、Y组成的化合物的沸点总低于由X与Z组成的化合物的沸点
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
下列实验操作:①取液体试剂,②取固体试剂,③溶解,④过滤,⑤蒸发。一定要用到玻璃棒的是
A.①②③ B.②③④ C.①②⑤ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com