
| A. | 只有③④ | B. | 只有①②⑤ | C. | 只有①②③ | D. | ①②③④⑤ |
分析 金属的金属性越强,该元素得电子能力越强,其单质的氧化性越强,其单质与氢气化合越容易,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,据此分析解答.
解答 解:金属的金属性越强,该元素得电子能力越强,其单质的氧化性越强,其单质与氢气化合越容易,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,
①甲单质比乙单质容易与氢气化合,说明非金属性甲大于乙,故正确;
②甲元素的单质能与乙的阴离子发生氧化还原反应,说明氧化性甲大于乙,则非金属性甲大于乙,故正确;
③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物的酸性强,说明非金属性甲大于乙,故正确;
④与某金属反应时,甲比乙得电子数多,与金属性强弱无关,所以不能比较非金属性强弱,故错误;
⑤甲的单质熔沸点比乙的单质低,与金属性强弱无关,与分子间作用力有关,所以不能比较非金属性强弱,故错误;
故选C.
点评 本题考查非金属性强弱判断,为高频考点,侧重考查学生知识综合运用能力及分析判断能力,明确非金属性强弱与得电子难易程度有关、与得电子多少无关是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碱金属中Li的还原性最强 | B. | 碱金属阳离子,氧化性最强的是Li+ | ||
| C. | 和Li同一主族的都是金属元素 | D. | Li在空气中加热生成过氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| B. | 同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3•H2O c(NH4+)由大到小的顺序是:②>①>③ | |
| C. | 0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合(忽略混合时体积变化):c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
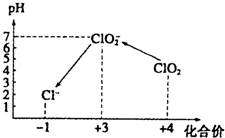 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | H2O2是由极性共价键和非极性共价键构成的非极性分子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加BaCl2溶液,观察是否生成沉淀 |
| B | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
| C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| D | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉看粉末是否变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
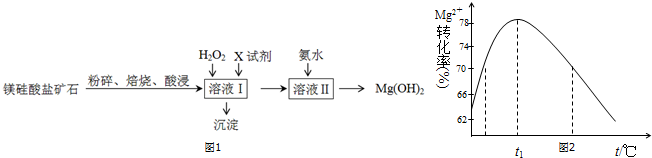
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com