
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
| n(H2) | n(SiHCl3) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:填空题
碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。
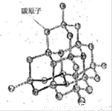
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
查看答案和解析>>
科目:高中化学 来源:2014届江苏省常州市高三上学期期中考试化学试卷(解析版) 题型:填空题
多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
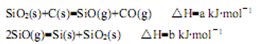
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
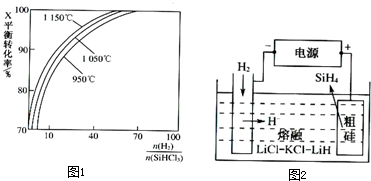
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
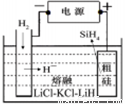
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(解析版) 题型:计算题
多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:

①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com