
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 102 | 74 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| B. | 气态氢化物的稳定性H2Z<H2W | |
| C. | X、Y元素的金属性X<Y | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,晶体类型为分子晶体.
,晶体类型为分子晶体.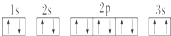 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 苯 | 溴 | 足量NaI溶液 | 分液 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
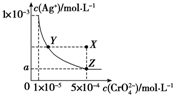
| A. | T℃时,在Y点和Z点,Ag2CrO4的Ksp相等 | |
| B. | 向饱和AgCrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 | |
| C. | T℃时,Ag2CrO4的Ksp为1×10-8 | |
| D. | 图中a=$\sqrt{2}$×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;
(1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com