
| A. | 酯化 | B. | 氧化 | C. | 加成 | D. | 水解 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 用KSCN溶液鉴别FeCl2溶液和Fe2(SO4)3溶液 | |
| D. | 用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10 -1 | 1.7×10 -5 | 6.2×10 -10 | K1=4.3×10-7 K2=5.6×10-11 |
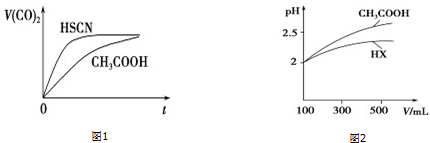
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  打磨磁石制指南针 | B. |  烧结粘土制陶瓷 | ||
| C. |  湿法炼铜 | D. |  铁的冶炼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol碳正离子CH3+所含的电子数为6NA | |
| C. | 室温下的乙烯和丁烯共21.0g,其中碳原子数为1.5NA | |
| D. | 标准状况下,1L 庚烷完全燃烧后,所生成的气态产物分子数为$\frac{7}{22.4}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化镁反应H++OH-=H2O | |
| B. | 铁与稀硝酸反应Fe+2H+=Fe2++H2↑ | |
| C. | 三氯化铁溶液与氨水反应Fe3++3OH-=Fe(OH)3↓ | |
| D. | 过量二氧化碳与石灰水反应 CO2+OH一=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇与乙酸互为同分异构体 | |
| C. | 二氯甲烷只有一种结构 | |
| D. | 等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④⑥ | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com