
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
分析 ①、物质完全燃烧放出的热量多余不完全燃烧;
②、固体硫变为气态硫需要吸收热量;
③、化学反应方程式的系数加倍,焓变数值加倍;
④、液态水变为气态水的过程是吸热过程.
解答 解:①、物质的燃烧反应是放热的,所以焓变值是负值,C不完全燃烧放出的热量少于完全燃烧放出的热量,则△H1<△H2,故正确;
②、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,气态硫燃烧放出的热量多,则△H1>△H2,故错误;
③、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,△H1=2△H2,则△H1<△H2,故D正确;
④、物质的燃烧反应是放热的,焓变是负值,液态水变为气态水的过程是吸热的,所以生成气态水放出的热量少,则△H1<△H2,故正确;
故选D.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化不同,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3溶解度大 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应得CO2物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国目前使用的主要能源是煤、石油和天然气 | |
| B. | 解决能源危机的方法是开发新能源和节约现有能源,提高能源的利用率 | |
| C. | 开发的新能源包括太阳能、氢能、核能等,它们都是可再生能源 | |
| D. | 提高燃料利用率的方式是科学控制反应,使燃料充分燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用甲所示的装置与操作检验某物质中K+的存在 | |
| B. | 用乙所示的装置除去氯气中的少量H2O | |
| C. | 用丙所示的装置分离酒精与水 | |
| D. | 用丁所示的装置收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
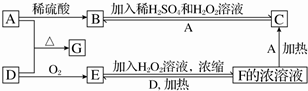
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com