
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 1 mol戊二醛与足量的银氨溶液反应,最多可得 2 mol银 | |
| C. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| D. | 戊二醛经催化氧化可以得到4种戊二酸 |
分析 A.根据结构简式写出其分子式,戊二醛可以看作2个-CHO取代丙烷中的2个H原子,据此判断戊二醛的同分异构体个数;
B.1mol醛基被银氨溶液氧化得到2molAg;
C.醛基能被酸性高锰酸钾溶液氧化;
D.戊二醛的同分异构体数目等于戊二酸的同分异构体数目.
解答 解:A.戊二醛分子式为C5H8O2,戊二醛可以看作2个-CHO取代丙烷中的2个H原子,取代同一碳原子上的2个H原子有2种结构,取代不同C原子上H原子有2种结构,符合此分子式的戊二醛有4种,故A错误;
B.1mol醛基被银氨溶液氧化得到2molAg,故1mol的戊二醛与足量的银氨溶液反应,最多可得4mol单质银,故B错误;
C.戊二醛含有醛基,性质较活泼,能被酸性高锰酸钾溶液氧化,所以戊二醛能使酸性高锰酸钾溶液褪色,故C错误;
D.戊二醛可以看作2个-CHO取代丙烷中的2个H原子,取代同一碳原子上的2个H原子有2种结构,取代不同C原子上H原子有2种结构,符合此分子式的戊二醛有4种,故催化氧化可以得到的戊二酸有4种同分异构体,故D正确,
故选D.
点评 本题考查有机物结构和性质、同分异构体种类判断,为高频考点,明确官能团及其性质关系、同分异构体种类判断方法是解本题关键,注意根据2个醛基取代丙烷判断同分异构体数目,注意醛能被弱氧化剂银氨溶液氧化,也能被强氧化剂酸性高锰酸钾氧化.


科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 复分解反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体吸收利用的太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品保存在冰箱中不易坏,说明温度对反应速率有影响 | |
| B. | 在金属与非金属的分界线附近寻找半导体材料 | |
| C. | 在周期表中,第IA族全部为金属元素 | |
| D. | 金刚石与石墨互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
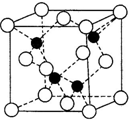 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_a^bR$ | B. | ${\;}_{a+2}^{a+b+2}R$ | C. | ${\;}_{a-2}^{a+b}R$ | D. | ${\;}_{a-2}^{a+b-2}R$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
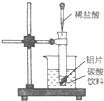 中.试回答下列问题:
中.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com