
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
【答案】C
【解析】
试题反应的化学方程式为Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;MgSO4+2KOH=Mg(OH)2↓+K2SO4;Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4;Mg(OH)2![]() MgO+H2O;2Al(OH)3
MgO+H2O;2Al(OH)3![]() Al2O3+3H2O。A.根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即b=22.4L/mol×[c×(v÷1000)÷2],整理得c="1000b/11.2V" ,A项正确;B.选项中p为生成的氧化物的质量,1molMg可结合1mol O,2molAl结合3molO,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,即p="[c×(v÷1000)÷2]×16+m=m+" Vc/125,B项正确;C.得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即n=m+c×v/1000×17=m+cv/1000×17,C项错误;D.氧化镁和氧化铝的质量可以按照极值方法计算,若mg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为P=m÷24×40=5/3m;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=m÷27×102×0.5=17/9m;质量介于二者之间,D项正确;答案选C。
Al2O3+3H2O。A.根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即b=22.4L/mol×[c×(v÷1000)÷2],整理得c="1000b/11.2V" ,A项正确;B.选项中p为生成的氧化物的质量,1molMg可结合1mol O,2molAl结合3molO,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,即p="[c×(v÷1000)÷2]×16+m=m+" Vc/125,B项正确;C.得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即n=m+c×v/1000×17=m+cv/1000×17,C项错误;D.氧化镁和氧化铝的质量可以按照极值方法计算,若mg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为P=m÷24×40=5/3m;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=m÷27×102×0.5=17/9m;质量介于二者之间,D项正确;答案选C。


科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 molL﹣1的H2SO4溶液反应,放出11.46 kJ的热量,下列热化学方程式正确的是
A. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
B. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =-11.46 kJmol﹣1
C. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =+114.6 kJmol﹣1
D. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO、CO2的应用及水体污染的治理是化学工作者研究的重要课题。
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去。已知: NH4++HClO=NH2Cl+H++H2O;ΔH=a kJ·mol-1
NH4++4HClO=NO3- +6H++4Cl-+H2O;ΔH=b kJ·mol-1。
2NH2Cl+HClO=N2+H2O+3H++3Cl-;ΔH=c kJ·mol-1
则2NH4++3HClO=N2+3H2O+5H++3Cl-;ΔH=_____ kJ·mol-1
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2![]() 2Na2CO3+C。放电时当电路中转移1mol电子时被还原的CO2的质量为_____;充电时,阳极的反应式为________
2Na2CO3+C。放电时当电路中转移1mol电子时被还原的CO2的质量为_____;充电时,阳极的反应式为________
(3)废水中重金属离子常用沉淀法除去,已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol·L-1,铜低于7.8×10-5 mol·L-1。则需要控制溶液中S2-的浓度不低于_____________mol·L-1。
(4)NO易被O2氧化为NO2。其他条件不变时,NO的氧化率α(NO)与温度、压强的关系如图1所示(p1线在p2的上方)则p1__p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是____
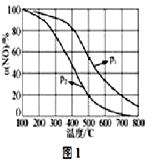
(5)环境中的有害物质常通过转化为CO2来降低污染,TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。下图2为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为_____。
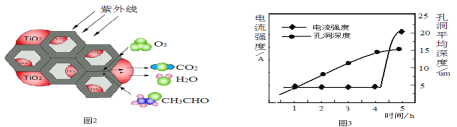
(6)用新型钛基纳米PbO2作电极可将苯、酚类等降解为CO2 和H2O。该电极可通过下面过程制备:将钛基板用丙酮浸泡后再用水冲洗,在钛板上镀上一层铝膜。用它做阳极在草酸溶液中电解,一段时间后,铝被氧化为氧化铝并同时形成孔洞。再用Pb(NO3)2溶液处理得纳米PbO2,除去多余的氧化铝,获得钛基纳米PbO2电极。电解时,电流强度和基板孔洞深度随时间变化如上图3所示,氧化的终点电流强度突然增加,其可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应
B. 根据图示,物质A为CO2
C. 为增强污水的导电能力,可向污水中加入适量乙醇
D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
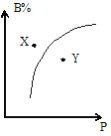
A.m+n>p
B.n>p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。下列说法不正确的是( )
A.还原性:NaN3 > N2
B.若有65 g NaN3参加反应,则生成的N2的物质的量为1.6 mol
C.每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D.被还原的N与被氧化的N为15 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A. 在标准状况下,4.48L水中含有的分子数目为0.2NA
B. 0.1mol![]() 离子含有的电子、中子数均为1.0NA
离子含有的电子、中子数均为1.0NA
C. 一定条件下,0.1mol![]() 与0.3mol
与0.3mol![]() 充分反应后的0.1NA个分子
充分反应后的0.1NA个分子
D. 总物质的量为0.1mol的CaO和![]() 混合物中,所含离子总数为0.2NA
混合物中,所含离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量具有凤梨香味的物质X,其结构如下图所示,下列说法正确的是
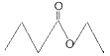
A. X难溶于乙醇
B. 酒中少量的丁酸能抑制X的水解
C. X完全燃烧后生成CO2和H2O的物质的量比为1:2
D. 分子式为![]() 且官能团与X相同的物质共有5种
且官能团与X相同的物质共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列几组物质中,互为同分异构体的有___________。
①O2和O3;②CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH(CH3)CH2C2H5;③丙烯和丁烯;④3-乙基己烷和辛烷;⑤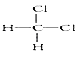 和
和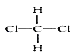
(2)用系统命名法给如图所示的有机物命名,其名称为_________________ 。
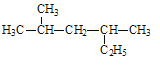
(3)甲烷在氯气中燃烧,可看到集气瓶内壁有黑色固体颗粒生成,瓶口产生大量白雾,据以上现象分析,上述反应的化学反应方程式为_______________________________。
(4)已知1g苯在氧气中完全燃烧放出的热量3.4 kJ,写出表示苯的燃烧热的热化学方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com