
分析 (1)根据c=$\frac{1000ρw}{M}$,计算求解;
(2)由n(H2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,所以0.78克镁铝共转移0.04×2mol=0.08mol的电子,再根据质量守恒求混合物中铝的质量;c=$\frac{n}{V}$计算求解;
(3)要使氢氧化铝和氢氧化镁沉淀分开加入氢氧化钠使氢氧化铝变成偏铝酸钠,此时溶液为偏铝酸钠和硫酸钠的混合体系,根据组成守恒求氢氧化钠的物质的量,再结合V=$\frac{n}{c}$.
解答 解:(1)根据c=$\frac{1000ρw}{M}$=$\frac{1000×30.625%×1.28}{98}$=4mol/L,故答案为:4;
(2)设0.78克混合物镁铝的物质的量分别为xmol、ymol,根据质量守恒和电子得失守恒得:$\left\{\begin{array}{l}{24x+27y=0.78}\\{2x+3y=0.08}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.01mol}\\{y=0.02mol}\end{array}\right.$,所以混合物中铝的质量为:0.02×27=0.54 g,故答案为:0.54 g;
(3)根据铝守恒得n(NaAlO2)=(Al)=0.02mol,而n(Na2SO4)=n(H2SO4)=4mol/L×25×10-3L=0.1mol,所以n(NaOH)=0.02+0.1×2=0.22mol,所以V=$\frac{0.22mol}{4mol/L}$=55mL,答:反应后溶液中加入4mol/L NaOH溶液的体积至少为55mL.
点评 本题考查物质的量浓度的计算、根据电子得失和质量守恒求铝的质量,第三小题要根据氢氧化铝的性质,要将两者分离加氢氧化钠恰好使氢氧化铝转化为偏铝酸钠,然后得到溶液根据溶液的组成求氢氧化钠的物质的量,有一定的难度.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题

| A. | a的溶解度大于b的溶解度 | |
| B. | 在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 | |
| C. | 升高温度时,a、b溶解度均增大 | |
| D. | 在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )| A. | B与C均不存在同素异形体 | B. | X一定是酸性氧化物 | ||
| C. | B的氢化物比A、C的氢化物稳定 | D. | A与B形成的化合物X有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
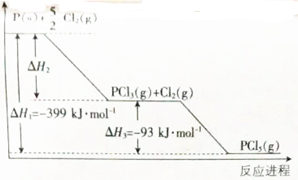
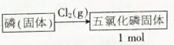

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++SO${\;}_{4}^{2-}$ | B. | H3PO4?3H++PO${\;}_{4}^{3-}$ | ||
| C. | NaHCO3═Na++H++CO${\;}_{3}^{2-}$ | D. | CaCO3?Ca2++CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
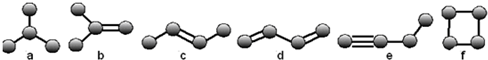
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加入硫酸溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | 向稀盐酸溶液中加铁 3Fe+6H+═3H2↑+3Fe3+ | |
| D. | 向硝酸银溶液中加盐酸 Ag++Cl-═AgCl↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com