
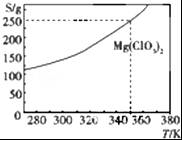
 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% | |
| D. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ |
分析 A.由图象可知,随着温度的升高,Mg(ClO3)2的溶解度增大;
B.由图象可知,随着温度的升高,Mg(ClO3)2的溶解度增大,根据饱和溶液中溶质质量分数的计算式=$\frac{溶解度}{溶解度+100}$×100%,可以知道溶解度越大质量分数也就越大;
C.根据饱和溶液中溶质质量分数的计算式=$\frac{溶解度}{溶解度+100}$×100%;
D.溶液的体积不知,无法计算物质的量浓度.
解答 解:A.由图象可知,随着温度的升高,Mg(ClO3)2的溶解度增大,则温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大,故A正确;
B.由图象可知,随着温度的升高,Mg(ClO3)2的溶解度增大,溶解度越大质量分数也就越大,则温度越高,Mg(ClO3)饱和溶液的质量分数越大,故B正确;
C.350K时,Mg(ClO3)2饱和溶液的溶解度为250g,溶质质量分数=$\frac{溶解度}{溶解度+100}$×100%=$\frac{250}{250+100}$×100%,故C正确;
D.350K时,Mg(ClO3)2饱和溶液的溶解度为250g,但是溶液的体积不知,无法计算物质的量浓度,故D错误;
故选D.
点评 本题考查了溶解度的含义、物质的量浓度、溶液质量分数的计算等,题目难度不大,侧重于考查学生的分析能力和读图能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:计算题
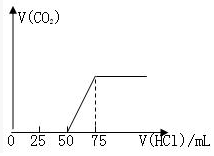 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
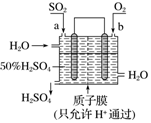
| A. | a为正极,b为负极 | |
| B. | 生产过程中氢离子由右移向左 | |
| C. | 从左下口流出的硫酸的质量分数一定大于50% | |
| D. | 负极反应式为SO2+2H2O-2e-═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取12.5g胆矾配成500mL溶液 | B. | 称取8.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取7.68g硫酸铜,加入500mL水 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:填空题
(1)可逆反应2Cl2(g)+2H2O(g  4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率___ _______;υ(逆)______________;
②保持容器体积不变,加入He,则HCl的物质的量__________。
③保持容器压强不变,加入He,则O2的物质的量__________;
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度 ____,相对分子质量_________。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+ 6C(s) + 2N2(g) Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
①该反应的平衡常数表达式为 K= ;
②若知上述反应为吸热反应,升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生 成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。
成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。
③达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com