
分析 加热条件下,MnO2和浓盐酸发生氧化还原反应生成MnCl2、Cl2和H2O,该反应中Mn元素化合价由+4价变为+2价、Cl元素由-1价变为0价,得电子化合价降低的反应物是氧化剂.
解答 解:加热条件下,MnO2和浓盐酸发生氧化还原反应生成MnCl2、Cl2和H2O,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
该反应中Mn元素化合价由+4价变为+2价、Cl元素由-1价变为0价,得电子化合价降低的反应物是氧化剂,所以MnO2是氧化剂,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;MnO2.
点评 本题考查化学方程式的书写及氧化剂判断,明确反应物、生成物及反应条件是解书写方程式关键,注意氧化剂、还原剂与元素化合价变化的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | Ca(OH)2和CO2 | C. | NaOH和HCl | D. | Na2CO3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡有两性 | |
| B. | 两支试管中产生的沉淀都是BaSO4 | |
| C. | 两支试管中的沉淀都是BaSO3 | |
| D. | H2SO3可被H2O2氧化为H2SO4,BaCl2与SO2不反应但能与SO${\;}_{3}^{2-}$反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
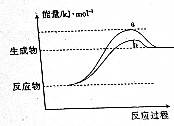 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:| 温度/K | N2的转化率 |
| 598 | a1 |
| 898 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
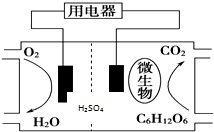
| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
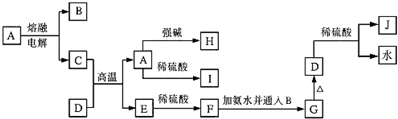
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com