
| A. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| B. | 某元素一种同位素原子的质子数为m,中子数为n.则这种元素的相对原子质量为m+n | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 仅由两种元素形成的共价化合物中可以同时含有极性共价键和非极性共价键强 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其简单阴离子的还原性越弱;
B.元素的相对原子质量与其核素及核素的丰度有关原子的相对原子质量在数值上等于其质量数;
C.同位素质子数相同、中子数不同;
D.同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其简单阴离子的还原性越弱,所以ⅦA族元素的阴离子还原性越强,该元素的非金属性越弱,则其最高价氧化物对应水化物的酸性越弱,故A错误;
B.元素的相对原子质量与其核素及核素的丰度有关原子的相对原子质量在数值上等于其质量数,所以该原子的相对原子质量为m+n而不是该元素的相对原子质量为m+n,故B错误;
C.同位素质子数相同、中子数不同,所以同种元素的不同原子质子数相同,中子数不同,故C错误;
D.同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键,仅由两种元素形成的共价化合物中可以同时含有极性共价键和非极性共价键强,如碳原子个数大于1的烃中含有极性键和非极性键,故D正确;
故选D.
点评 本题考查元素周期律、基本概念、原子结构、化学键等知识点,为高频考点,侧重考查学生对元素周期律、基本概念、原子结构的掌握和运用,知道非金属性强弱与其阴离子还原性、最高价含氧酸强弱的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的 某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂 |
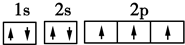 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.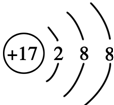 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com