
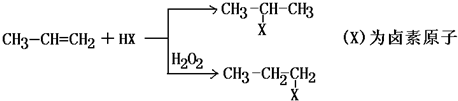

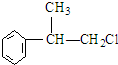 ,
,
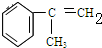 C的结构简式:
C的结构简式: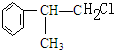 .
.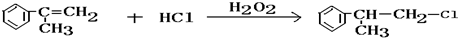 .
.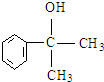 等.
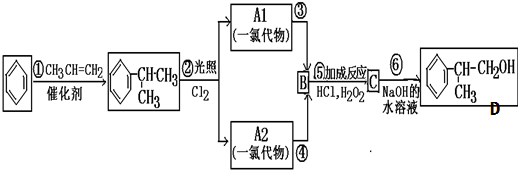
等. 分析 苯和丙烯在催化剂条件下反应生成异苯丙烷,异苯丙烷在光照条件下和氯气发生取代反应生成A1和A2,A是一氯代物,则支链上取代位置可能是甲基也可能是次甲基,A的结构简式可能是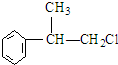 或
或 ,
,
A反应生成B,B和氯化氢发生加成反应生成C,则A发生消去反应生成B,B的结构简式为: ,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为:
,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为: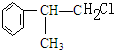 ,据此分析解答.
,据此分析解答.
解答 解:苯和丙烯在催化剂条件下反应生成异苯丙烷,异苯丙烷在光照条件下和氯气发生取代反应生成A1和A2,A是一氯代物,则支链上取代位置可能是甲基也可能是次甲基,A的结构简式可能是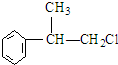 或
或 ,
,
A反应生成B,B和氯化氢发生加成反应生成C,则A发生消去反应生成B,B的结构简式为: ,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为:
,C是氯代烃,C发生水解反应生成D,根据D结构简式知,C的结构简式为: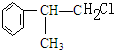 ,
,
(1)通过以上分析知,反应①的反应类型是加成反应,故答案为:加成反应;
(2)A的结构简式可能是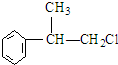 或
或 ,
,
故答案为: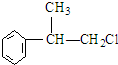 ;
; ;
;
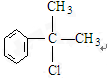
(3)B、C结构简式分别为 、
、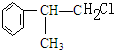 ,故答案为:
,故答案为: ;
;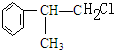 ;
;
(4)该反应方程式为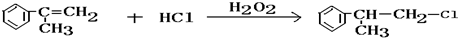 ,
,
故答案为: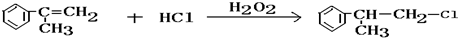 ;
;
(5)D是 ,与D的碳架结构相同且含有羟基的同分异构体就是将羟基位置进行移动,可得4种同分异构体,有
,与D的碳架结构相同且含有羟基的同分异构体就是将羟基位置进行移动,可得4种同分异构体,有 等,
等,
故答案为: 等.
等.
点评 本题考查了有机物的推断,明确有机物的官能团、性质及其反应条件是解本题关键,反应物相同条件不同导致产物不同,方程式和同分异构体的书写是常考查点,侧重考查学生分析判断能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
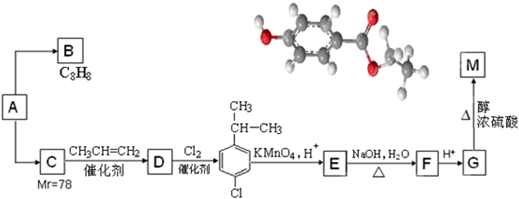
 .
.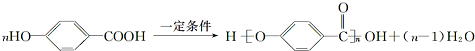 .
.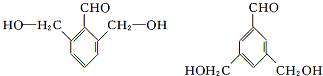 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Al | C. | HCO${\;}_{3}^{-}$ | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
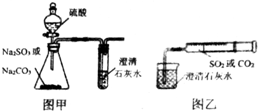 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室制取乙烯 | B. |  利用酒精萃取碘水中的I2单质 | ||
| C. | 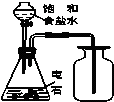 实验室制取乙炔并收集 | D. |  石油的分馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
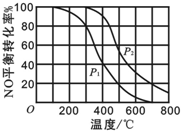 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com