
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族的元素的原子次外层电子数不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物之间能两两反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
分析 W、X、Y、Z是原子序数依次增大的四种元素短周期元素,四种元素的电子层数之和等于10,如果W是第一周期元素,则X、Y、Z位于第三周期,且X的原子半径最大,符合题给信息,所以W是H元素、X是Mg元素、Y是Al元素、Z是Si元素;
如果W是第二周期元素,则X为第二周期、Y和Z为第三周期元素才符合四种元素的电子层数之和等于10,但原子半径最大的元素不可能为X元素,不符合题意,再结合题目分析解答.
解答 解:W、X、Y、Z是原子序数依次增大的四种元素短周期元素,四种元素的电子层数之和等于10,如果W是第一周期元素,则X、Y、Z位于第三周期,且X的原子半径最大,符合题给信息,所以W是H元素、X是Mg元素、Y是Al元素、Z是Si元素;
如果W是第二周期元素,则X为第二周期、Y和Z为第三周期元素才符合四种元素的电子层数之和等于10,但原子半径最大的元素不可能为X元素,不符合题意.
A.W位于第一周期,X、Y、Z位于第三周期,故A错误;
B.W是H元素,W所在主族元素的原子次外层电子数为稀有气体最外层电子数,可能为2或8,如Li、Na、Rb,不可能为18,故B正确;
C.X、Y、Z的最高价氧化物对应的水化物分别为氢氧化镁、氢氧化铝、硅酸,两两之间均不能反应,故C错误;
D.Mg、Al属于活泼金属,工业上采用电解熔融氯化镁的方法冶炼Mg,采用电解熔融氧化铝的方法冶炼Al,故D错误,
故选B.
点评 本题考查原子结构和元素性质,正确推断元素是解题关键,注意对基础知识的理解掌握,题目难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题

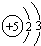 ;
;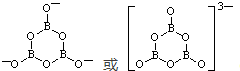 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
| A. | ⑦的简单离子不是同周期元素离子半径最小的 | |
| B. | 气态氢化物的稳定性①>② | |
| C. | 气态氢化物的沸点高低②>④ | |
| D. | 阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数 | B. | 电子数 | C. | 原子序数 | D. | 质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(D)=0.0075 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶物只有铜 | |
| B. | 不溶物一定含铜,可能含铁 | |
| C. | 不溶物只有铁 | |
| D. | 溶液中一定含有Fe2+,可能含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③能与水在一定条件下反应生成C
③能与水在一定条件下反应生成C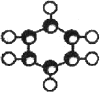
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
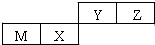
| A. | 原子半径Z>Y | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Y的气态氢化物比Z气态氢化物稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com