
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
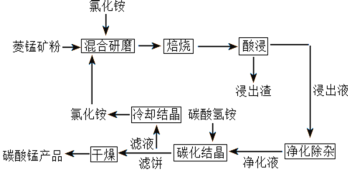
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
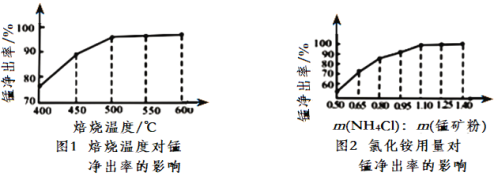
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
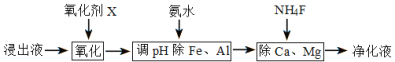
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
【答案】加快反应速率 MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 温度为500℃ 且 m(MnCO3):m(NH4Cl)=1.10 B 5.2≤pH<8.8 1.97
MnCl2+2NH3↑+CO2↑+H2O 温度为500℃ 且 m(MnCO3):m(NH4Cl)=1.10 B 5.2≤pH<8.8 1.97 ![]() ×10-7 CO32-水解程度大于HCO3-,易生成氢氧化物沉淀
×10-7 CO32-水解程度大于HCO3-,易生成氢氧化物沉淀
【解析】
根据流程:将菱锰矿粉(主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素)和氯化铵混合研磨后焙烧:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+,反应为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,加入碳酸氢铵发生反应:Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+,反应为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,加入碳酸氢铵发生反应:Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析作答。
MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析作答。
(1)“混合研磨”可使物质充分接触,加快反应速率;
(2)“焙烧”时发生的主要反应的化学方程式为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(3) 根据图可知,锰的浸出率随着温度的升高而增大,随着m(NH4Cl):m(锰矿粉)增大而增到,500℃、m(NH4Cl):m(锰矿粉)=1.10时,锰的浸出率最高,温度过高,m(NH4Cl):m(锰矿粉)增大,浸出率变化不大,成本增加,故焙烧温度取500℃、m(NH4Cl):m(锰矿粉)=1.10即可;
(4)①根据分析,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入氧化剂X的目的将Fe2+氧化为Fe3+,同时在选择氧化剂时,要尽可能不要引入新的杂质,则氧化剂X宜选择MnO2,答案选B;
②根据分析,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液主要溶质主要为MnCl2、NH4Cl,过程中不能让Mn2+沉淀,结合相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围表,Al3+、Fe3+完全沉淀时的pH值分别为5.2和2.8,Mn2+开始沉淀的PH值为8.8,pH可取的范围为5.2≤pH<8.8;
③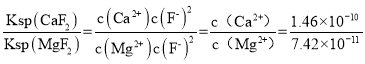 ≈1.97;若此时pH为6,即c(H+)=10-6 mol/L,c(Mg2+)= a mol/L,c(F-)=
≈1.97;若此时pH为6,即c(H+)=10-6 mol/L,c(Mg2+)= a mol/L,c(F-)=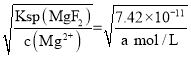 mol/L,HF是弱酸,在溶液中部分电离,已知Ka(HF)=
mol/L,HF是弱酸,在溶液中部分电离,已知Ka(HF)=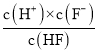 =1.00×104则c(HF)=
=1.00×104则c(HF)=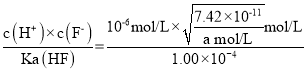 =
= ![]() ×10-7mol/L;
×10-7mol/L;
(5)“碳化结晶”过程中,因为碳酸根离子水解程度大,碳酸铵溶液中c(OH)较大,易产生Mn(OH)2沉淀,故碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液。


科目:高中化学 来源: 题型:
【题目】根据已学知识,回答下列问题。
(1)已知下列元素基态原子的电子排布式,判断它们所在的周期和族。
①![]() ___________________ ;
___________________ ;
②![]() ___________________ ;
___________________ ;
③![]() ___________________ ;
___________________ ;
④![]() ___________________ 。
___________________ 。
(2)已知下列元素在周期表中的位置,写出它们的元素符号和价电子排布式。
①第4周期IVB族____________、____________;
②第5周期VIIA族____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯和苯分子中的化学键描述正确的是( )
A.苯分子中每个碳原子的![]() 杂化轨道中的其中一个形成大
杂化轨道中的其中一个形成大![]() 键
键
B.乙烯分子中![]() 键是
键是![]() 杂化轨道形成的
杂化轨道形成的![]() 键
键![]() 键是未参加杂化的
键是未参加杂化的![]() 轨道形成的
轨道形成的![]() 键
键
C.苯分子中碳碳键是![]() 杂化轨道形成的
杂化轨道形成的![]() 键,
键,![]() 键是未参加杂化的
键是未参加杂化的![]() 轨道形成的
轨道形成的![]() 键
键
D.乙烯和苯分子中每个碳原子都以![]() 杂化轨道形成
杂化轨道形成![]() 键,未杂化的
键,未杂化的![]() 轨道形成
轨道形成![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10mL 0.10mol·L-1NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是
与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是
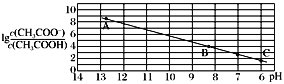
A.Ka(CH3COOH)=5.0×10-5
B.Ka(CH3COOH)=5.0×10-6
C.pH=7时加入的醋酸溶液的体积小于10 mL
D.B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是( )
)的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是( )
A.①②④⑥B.①②④⑤⑥C.①②④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是( )
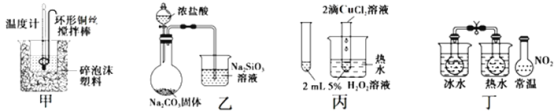
A.图甲:进行中和热的测定
B.图乙:比较 HCl、H2CO3和H2SiO3的酸性强弱
C.图丙:验证 CuCl2对 H2O2 分解有催化作用
D.图丁:验证 2NO2(g)![]() N2O4 (g) △H<0
N2O4 (g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因___。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比___(填“>”、“<”或“=”)10。
(3)向10mL0.1mol/L的氨水中逐滴加入20mL0.1mol/L的醋酸,溶液导电性的变化是___。写出二者反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如图所示,甲装置能将H2O和CO2转化为C6H12O6和O2,X、Y是特殊催化剂型电极,乙装置为甲醇—空气燃料电池。下列说法不正确的是

A.b口通入空气,c口通入甲醇
B.甲装置中H+向X极移动,乙装置中H+向M极移动
C.理论上,每生成22.4LO2(标况下),必有4mol电子由N极移向X极
D.阳极上的电极反应式为6CO2 + 24H+ + 24e- = C6H12O6 + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C三种分子所含原子的数目依次为1、3、6,且分子中均含有18个电子,B、C是由两种元素组成的,且分子中两种元素原子的个数比均为1:2。请回答下列问题。
(1)A的分子式是__________,写出A原子的价电子排布式:__________
(2)B分子的中心原子的杂化类型是__________,分子的空间构型是__________,该分子属于__________(填“极性”或“非极性”)分子。
(3)C的化学式是__________,分子中含有的化学键类型是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com