
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.分析 A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,则A位于第一周期且为主族元素,为H元素;
A与E位于同一主族且E原子序数大于B、C、D,则E是Na元素;
F的质子数比D多5,D的最外层电子数是F的2倍,则D是O元素、F是Al元素;
C和D的最外层电子数之和为11,则C为N元素;
D和L位于同一主族,则L为S元素,I为Cl元素;
B和G位于同一主族,且G原子序数大于13而小于16,B原子序数小于7,则B是C、G是Si元素;
所以A、B、C、D、E、F、G、L、I分别是H、C、N、O、Na、Al、Si、S、Cl元素;
(1)非金属性越强,其氢化物的稳定性越强,E、F、L分别是Na、Al、S元素,E、F、L所形成的简单离子,离子电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(2)由S、Cl两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X结构式为Cl-S-S-Cl,据此书写X电子式;
固体化合物Na2O2投入到化合物Na2S的水溶液中,只观察到有沉淀产生的,二者发生氧化还原反应生成S和NaOH;
(3)在10L的密闭容器中,通入2mol SO2气体和1mol O2气体,一定温度下反应后生成SO3气体,当反应达到平衡时,O2的浓度为0.02mol•L-1,则参加反应的n(O2)=1mol-0.02mol/L×10L=0.8mol,根据SO2(g)+O2(g)?2SO3(g)知,参加反应的n(SO2)=2n(O2)=2×0.8mol=1.6mol,则平衡时SO2的转化率=$\frac{参加反应的n(S{O}_{2})}{反应初始n(S{O}_{2})}$×100%.
解答 解:A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,则A位于第一周期且为主族元素,为H元素;
A与E位于同一主族且E原子序数大于B、C、D,则E是Na元素;
F的质子数比D多5,D的最外层电子数是F的2倍,则D是O元素、F是Al元素;
C和D的最外层电子数之和为11,则C为N元素;
D和L位于同一主族,则L为S元素,I为Cl元素;
B和G位于同一主族,且G原子序数大于13而小于16,B原子序数小于7,则B是C、G是Si元素;
所以A、B、C、D、E、F、G、L、I分别是H、C、N、O、Na、Al、Si、S、Cl元素;
(1)非金属最弱的是硅,所以气态氢化物稳定性最弱的是硅化氢,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Na+>Al3+,
故答案为:SiH4;S2-;Na+;Al3+;
(2)氯和硫两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,的分子式为S2Cl2,电子式为: ,固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S+2Na++4OH-,
,固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S+2Na++4OH-,
故答案为: ;Na2O2+2H2O+S2-=S↓+2Na++4OH-;
;Na2O2+2H2O+S2-=S↓+2Na++4OH-;
(3)在10L的密闭容器中,通入2mol SO2气体和1mol O2气体,一定温度下反应后生成SO3气体,当反应达到平衡时,O2的浓度为0.02mol•L-1,则参加反应的n(O2)=1mol-0.02mol/L×10L=0.8mol,根据SO2(g)+O2(g)?2SO3(g)知,参加反应的n(SO2)=2n(O2)=2×0.8mol=1.6mol,则平衡时SO2的转化率=$\frac{参加反应的n(S{O}_{2})}{反应初始n(S{O}_{2})}$×100%=$\frac{1.6mol}{2mol}$×100%=80%,
故答案为:80%.
点评 本题结构性质位置关系综合应用,涉及元素周期律、比较离子半径、电子式、氧化还原方程式书写等,难度中等,推断元素是解题的关键,注意S2Cl2电子式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 组成为C4H8的化合物性质都相同 | |
| B. | 氢弹原料D、T,可由${\;}_1^1$H在化学反应中制取 | |
| C. | 粗铜电解精炼时,阳极减少的质量一定等于阴极增加的质量 | |
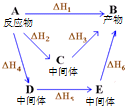
| D. | 图中物质A经不同途径生成B时,焓变满足:△H1=△H2+△H3=△H4+△H5+△H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, ,R的最简单氢化物的电子式为
,R的最简单氢化物的电子式为 ,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).
,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
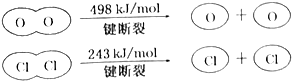
| A. | 反应A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O键比HCl中H-Cl键弱 | |
| C. | 由II中的数据判断氯元素的非金属性比氧元素强 | |
| D. | 断开1molH-O键与断开1molH-Cl键所需能量相差31.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15 | 20 | 25 | 30 | 35 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
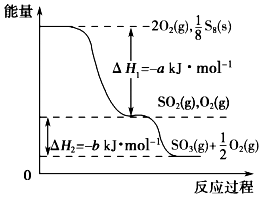 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com