
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |


科目:高中化学 来源: 题型:
| A、气体摩尔体积就是22.4L/mol |
| B、非标准状况下,1mol任何气体的体积不可能为22.4L |
| C、标准状况下22.4L任何物质都含有约6.02×1023个分子 |
| D、1molH2和O2的混合气体在标准状况下的体积约22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
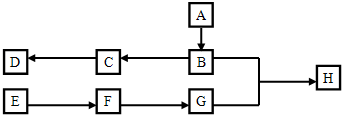
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
某研究性学习小组为了制取并探究氨气的性质,进行以下实验.[装置A中发生反应的化学方程式:2NH4Cl+Ca(OH)2
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
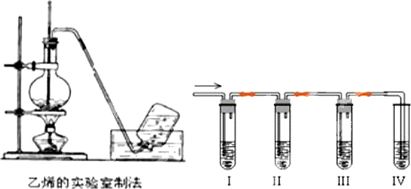
查看答案和解析>>
科目:高中化学 来源: 题型:
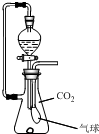 在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )| A、NaOH与Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3与NaHCO3 |
| D、NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、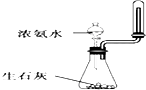 制取少量氨气 |
B、 除去氯气中的HCl杂质 |
C、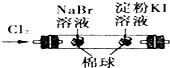 证明氧化性Cl2>Br2>I2 |
D、 制取HCl且除去多余的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com