
| A. | ①④⑤⑧⑨ | B. | ①②③⑥⑦⑨ | C. | ①②③④⑥⑦⑨⑩ | D. | ①②③④⑥⑦⑨ |
分析 ①Na2O2能够与水、二氧化碳反应生成氧气;
②晶体Si为良好的半导体材料;
③AgI能用于人工降雨;
④依据侯氏制碱法原理解答;
⑤依据铝热反应的用途解答;
⑥NaClO具有强氧化性,能杀菌消毒;
⑦Fe2O3为红棕色固体;
⑧SO2有毒;
⑨NH3汽化吸收大量的热;
⑩水玻璃是硅酸钠的水溶液.
解答 解:①Na2O2能够与水、二氧化碳反应生成氧气,可做供氧剂,故正确;
②晶体Si为良好的半导体材料,能制造太阳能电池,故正确;
③AgI能用于人工降雨,故正确;
④氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,故正确;
⑤利用铝热反应原理焊接钢轨,故错误;
⑥病毒属于蛋白质,NaClO具有强氧化性,能使蛋白质变性而杀菌消毒,故正确;
⑦Fe2O3为红棕色固体,能作红色油漆或涂料,故正确;
⑧二氧化硫有毒,不能用作食品添加剂,故错误;
⑨NH3汽化吸收大量的热,具有制冷作用,常用作制冷剂,故正确;
⑩水玻璃是硅酸钠的水溶液,用作木材的防火剂,故正确;
故选:C.
点评 本题考查了物质的用途,明确物质的性质是解本题关键,性质决定用途,用途体现性质,注意对相关知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
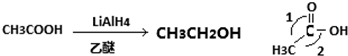
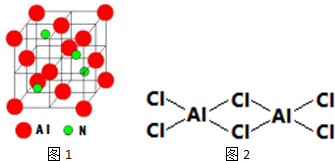
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
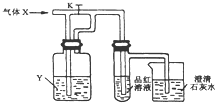
| A. | X是SO2,Y是饱和NaHCO3 溶液 | B. | X是H2S,Y是浓H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

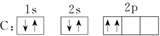
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
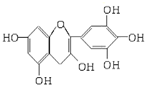 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )| A. | ②④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
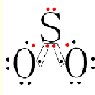 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com