
(10分)降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生
反应:CO2(g)+3H2(g) 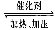 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
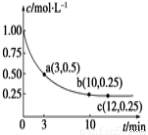
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反
应是 (填“吸热”或“放热”)反应。
②500℃达平衡时,CH3OH的体积分数为 。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述(1)中反应的逆反应。
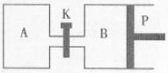
已知:起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(10分)
(1)①放热(1分) ②30%或0.30(3分)
(2) 75% (3分), 1.75a(3分)
【解析】
试题分析:(1)①由图2可知,只能反应的速率都增大,所以改变的条件是温度升高,逆反应速率大于正反应速率,平衡逆向移动,所以正向是放热反应;
②由题意可知,平衡时二氧化碳的平衡浓度是0.25mol/L,则氢气的平衡浓度是3×0.25mol/L=0.75mol/L,甲醇与水蒸气的平衡浓度都是0.75mol/L,则平衡时甲醇的体积分数也是物质的量浓度分数=0.75/(0.75+0.75+0.75+0.25)=0.3;
(2)A是恒温恒容条件,B是恒温恒压条件,达平衡时B容器体积变为原来的1.5倍,即气体的物质的量变为原来的1.5倍,根据 发生的反应,设甲醇转化的物质的量是xmol,
CH3OH(g)+H2O(g)  CO2(g)+3H2(g)
CO2(g)+3H2(g)
开始(mol) 1.2 2.4 0 0
转化(mol) x x x 3x
平衡(mol) 1.2-x 2.4-x x 3x
根据题意得1.2-x+2.4-x+x+3x=1.5×(1.2+2.4)=5.4,解得x=0.9,所以甲醇的转化率是0.9/1.2×100%=75%;K打开后整体都是恒温恒压容器,则再达平衡时与B的平衡是等效平衡,此时容器中反应物的总物质的量是1.2+2.4+1+2=6.6mol,是B中气体物质的量3.6mol的6.6/3.6=1.83倍,则新平衡时容器的总体积是1.5a的1.83倍,即平衡时容器的总体积是1.5a×1.83=2.75a,所以此时B容器的体积是2.75a-a=1.75a。
考点:考查平衡的移动与条件的关系,化学平衡的计算,等效平衡的判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
在恒温条件下,体积固定的密闭容器中,进行可逆反应A(s)+3B(g)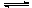 3C(g),下列不能说明可逆反应达到平衡状态的是
3C(g),下列不能说明可逆反应达到平衡状态的是
A.B的浓度不再变化
B.混合气体的压强不再变化
C.混合气体的密度不再变化
D.混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数增大,化学反应速率可能增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应活化能,增大活化分子百分数,增大化学反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+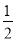 O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
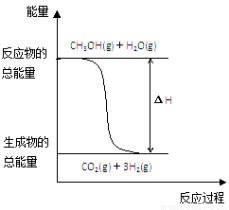
下列说法正确的是
A.若用甲醇(CH3OH)为原料设计成燃料电池,则通入甲醇的电极为正极
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+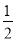 O2(g)===CO2(g)+2H2(g) 的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) 的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
如图所示,△H1=-393.5kJ/mol, △H2=-395.4kJ/mol,下列说法或表示式正确的是
A.石墨和金刚石的转化是物理变化
B.C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C.金刚石的稳定性强于石墨
D.断裂1mol石墨化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项 | x | y |
A | MgSO4的质量(忽略体积) | CO的转化率 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知可逆反应X(g)+2Y(g) Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是
Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是
A.a点正反应速率大于逆反应速率
B.增大X的浓度,X的转化率增大
C.容器中压强恒定时,不能说明反应已达平衡状态
D.保持温度和密闭容器的压强不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:选择题
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是
A.X是强酸,Y是弱酸 B.X是弱酸,Y是强酸
C.X是二元酸,Y是一元酸 D.无法判断X、Y的上述性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(A)试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.Fe与稀硫酸的反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙与盐酸反应:CO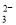 +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.氢氧化钡与稀硫酸混合:OH-+H+=H2O
D.氨水与盐酸混合:NH3?H2O+H+=NH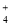 +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com