
| 1mol×[4-(-1)] |
| 1mol×2×[0-(-1)] |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、NaClO3中Cl的化合价是+5 |
| B、被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5 |
| C、Cl2既是氧化剂又是还原剂 |
| D、每生成1mol的NaClO3转移6mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
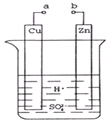 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献. 查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 14 |
| 6 |
| 14 |
| 7 |
| 16 |
| 8 |
| 35 |
| 17 |
| 235 |
| 92 |
| 238 |
| 92 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 叶绿素 |
| 光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2 | 充电 |
| 放电 |
| A、电池的电解液可为LiCl水溶液 |
| B、该电池放电时,负极发生还原反应 |
| C、充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 |
| D、放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com