
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
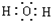 ;2K+2H2O=2KOH+H2↑;
;2K+2H2O=2KOH+H2↑;

科目:高中化学 来源: 题型:
| A、金刚石和富勒烯(C60) |
B、CH3CH2CH2CH3和 |
| C、12CO和14CO |
| D、CH3CH3 和CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol?L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
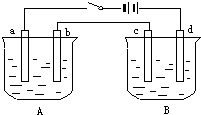 用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | KCl |
| 3 | CuSO4 | NaOH |
| 4 | Na2SO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| X | 形成的单质是最轻的物质 |
| Y | 原子基态时最外层电子数是其内层电子数的2倍 |
| Z | 原子基态时2p原子轨道上有3个未成对的电子 |
| W | 原子序数为29 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl |
| B、NaF |
| C、Na2O |
| D、K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com