
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
| A. | 完成该实验需用到的实验仪器有试管和胶头滴管 | |
| B. | CCl4在实验中所起的作用是萃取剂 | |
| C. | ③中反应的离子方程式为Cl2+2I-═2Cl-+I2 | |
| D. | 上述三步实验能很好的探究卤素单质的氧化性强弱 |
分析 A.做该实验时,盛放液体的仪器用试管,滴加液体的仪器用胶头滴管;
B.溴、碘易溶于四氯化碳,但钠盐溶液不易溶于四氯化碳,且四氯化碳和水不互溶;
C.氯气和碘离子反应生成碘单质和氯离子;
D.该实验能证明氯气的氧化性大于溴、碘,但不能证明溴的氧化性大于碘.
解答 解:A.做该实验时,盛放液体的仪器用试管,滴加液体的仪器用胶头滴管,所以完成该实验需用到的实验仪器有试管和胶头滴管,故A正确;
B.溴、碘易溶于四氯化碳,但钠盐溶液不易溶于四氯化碳,且四氯化碳和水不互溶,所以四氯化碳作该实验的萃取剂,故B正确;
C.氯气和碘离子反应生成碘单质和氯离子,离子方程式为Cl2+2I-═2Cl-+I2,故C正确;
D.该实验能证明氯气的氧化性大于溴、碘,但不能证明溴的氧化性大于碘,要想探究卤素单质的氧化性强弱还需要补充一个实验:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色,故D错误;
故选D.
点评 本题以探究卤素单质氧化性强弱为载体考查实验基本操作及评价,为高频考点,明确实验原理、物质性质是解本题关键,实验设计要规范、严密,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
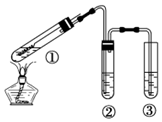
| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式为SiO2 | B. | 2-丁烯的键线式: | ||
| C. | 丙烷分子的球棍模型示意图: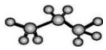 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
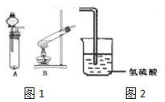 某研究性学习小组设计了一组实验来验证元素周期律.
某研究性学习小组设计了一组实验来验证元素周期律. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Rn+>Zm- | |
| B. | 若Y的最高价氧化物对应的水化物HnY0m为强酸,则X的氢化物沸点一定比Y的氢化物的沸点低 | |
| C. | 若X的气态氢化物能使湿润的石蕊试纸变蓝,则标准状况下,18g Y的氢化物的体积为2.24 L | |
| D. | 若R(OH)n为弱电解质,则W(OH)n+1可与KOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
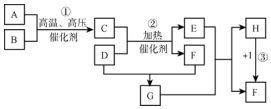
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
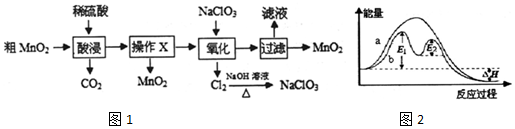
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com