
 氢气、甲醇是优质的清洁燃料,可制作燃料电池.
氢气、甲醇是优质的清洁燃料,可制作燃料电池.分析 (1)根据盖斯定律书写目标热化学方程式;
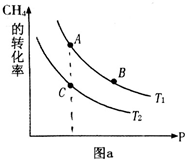
(2)①正反应为吸热反应,压强一定时,升高温度,平衡向正反应方向移动,甲烷的转化率增大,据此判断温度大小;
平衡常数只受温度影响,处于等温线上各点平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大;
②达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断;
③利用三段式计算平衡时各组分的物质的量浓度,代入平衡常数表达式计算.
解答 解:(1)已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(1)△H3=-44.0kJ/mol
根据盖斯定律,①×$\frac{1}{2}$-②×$\frac{1}{2}$+③×2得:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=-442.8 kJ•mol-1,
答:热化学方程式为CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=-442.8 kJ•mol-1;
(2)①由图开始,压强一定时,温度T1的转化率较大,正反应为吸热反应,升高温度,平衡向正反应方向移动,甲烷的转化率增大,故温度Tl>T2;
平衡常数只受温度影响,A、B处于等温线上,平衡常数相等,由图可知,压强一定时,温度T1条件下,甲烷的转化率更大,则反应进行的程度更大,比温度T2时的平衡常数大,故平衡常数KA=KB>KC,
故答案为:>;KA=KB>KC;
②a.随反应进行混合气体总物质的量增大,容器容积不变,压强增大,当容器的压强恒定时,说明到达平衡,故a正确;
b.单位时间内消耗0.1mol CH4同时生成0.3molH2,反应始终按此比例进行,不能说明到达平衡,故b错误;
c.100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变,不能说明得到平衡,故c错误;
d.3v正(CH4)=v逆(H2),不同物质的正逆速率之比等于化学计量数之比,反应到达平衡,故d正确,
故答案为:ad;
③平衡时甲烷的转化为0.5,则甲烷的浓度变化量=1mol/L×0.5=0.5mol/L,
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 1.5
平衡(mol/L):0.5 1.5 0.5 1.5
故平衡常数K=$\frac{0.5×1.{5}^{3}}{0.5×1.5}$=2.25,
故答案为:2.25.
点评 本题考查化学平衡的计算,题目难度中等,涉及热化学方程式、化学平衡图象及影响因素、平衡常数、平衡状态判断等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 酒精含有的分子数为NA | |
| B. | 500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积约为22.4 L | |
| D. | 通常状况下,71 g Cl2所含原子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com