
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中![]() _________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
_________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:________________。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为______________________。
(3)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L-1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:

①在同一溶液中,H2CO3、HCO3-、CO32-____(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为____________,溶液中各种离子的物质的量浓度的大小关系为____________。
③已知在25 ℃时,CO32-水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
=2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳捕捉技术即是二氧化碳的捕集、利用与封存(CCUS),是实现温室气体减排的重要途径之一,更是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
I.利用CO2加氢合成低碳烯烃技术就是重要的应用之一。以合成C2H4为例,其合成反应为:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
(1)ΔH1=__________________(请用△H2、△H3、△H4表示),若将1mol CO2与3mol H2充入10L的恒容密闭容器中,达到平衡后,平衡浓度、CO2转化率与温度的关系分别如图1和图2所示,请回答下列问题:


(2)图1中曲线c代表物质的电子式___________________。
(3)该反应在较低温度时能自发进行,请分析其原因:______________________________。
(4)结合图1和图2,下列说法一定正确的是 __________。
A.其他条件不变,T1℃、增大压强,再次达到平衡时c(H2)比A点的c(H2)大
B.平衡常数:KM>KN
C.生成乙烯的速率:v(M)小于v(N)
(5)计算图2中M点时,乙烯的体积分数________________。(保留二位有效数字)
II.利用电解法也可将CO2制得乙烯,如图3所示,电极b是太阳能电池的________极,
电解时其中a极对应电解槽上生成乙烯的电极反应式为______________________________。
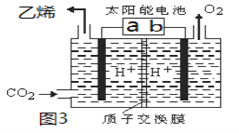
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的重要原料,新旧合成方法如下:
旧合成方法:(CH3)2C=O+HCN![]() (CH3)2C(OH)CN
(CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4 ![]() CH2=C(CH3)COOCH3+NH4HSO4
CH2=C(CH3)COOCH3+NH4HSO4
新合成方法:CH3C![]() CH+CO+CH3OH
CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列叙述中,正确的是
A. 甲基丙烯酸甲酯属于高分子 B. 新合成方法的原料无爆炸危险
C. 新合成方法的原料利用率高 D. 新合成方法的原料都是无毒物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示。

(1)负极的电极反应式是________,该反应属于_______ (填“氧化”或“还原”)反应。
(2)电子由________(填“锌片”或“铜片”)沿导线流出。
(3)当铜表面析出0.224 L氢气(标准状况)时,导线中通过了________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )
CH3OH(g)+H2O(g) △H<0。500℃时,在体积为1L的固定容积的密闭容器中充入lmolCO2、3molH2,测得CO2浓度与CH3OH浓度随时间的变化如图所示,下列结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到l0min时,H2的反应速率v(H2)=0.225 mol/(L·min)
C. 平衡时H2的转化率为75%
D. 500℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液500mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是__________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1cm~2cm处
(3)关于容量瓶的四种叙述:
①是配制准确浓度溶液的仪器
②不宜贮存溶液
③不能用来加热
④使用之前要检查是否漏水
这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。固体应放在_______中称量。
(5)下面操作造成所配溶液浓度偏高的是__________(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D. 摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com