
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 | |
| D. | 洗涤油污常用热的碳酸钠溶液 |
分析 A.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,硫酸铝水解生成氢氧化铝和硫酸,当溶液蒸干时,得到的固体是硫酸铝;
B.加入盐酸,引入杂质;
C.碳酸钠溶液呈碱性;
D.油脂在碱性条件下可水解.
解答 解:A.氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,灼烧时氢氧化铝分解生成氧化铝和水蒸气,所以得到的固体为Al2O3,硫酸铝水解生成氢氧化铝和硫酸,加热促进硫酸铝水解,因为硫酸没有挥发性,所以得到的固体仍然是Al2(SO4)3,故A错误;
B.加入盐酸,引入杂质,应加入硫酸酸化,故B错误;
C.碳酸钠溶液呈碱性,易导致玻璃塞打不开,故C错误;
D.碳酸钠溶液呈碱性,油脂在碱性条件下可水解,故D正确;
故选D.
点评 本题考查了盐类水解、该考点是高考考查的重点和热点,本题比较贴近生活,有利用激发学生学习化学的兴趣,该题难度适中.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:实验题
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| 投料比[n(NO2)/n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
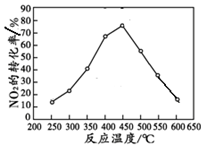
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
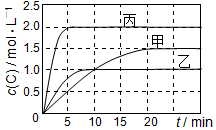 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大 | |
| B. | 达到平衡时反应吸收的热量:Q丙>2Q乙 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 在该容器中先投入1molSO3,平衡后再加入1molSO3,达新平衡后SO2的体积分数比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻和丝分别属于纤维素、酯类和蛋白质 | |
| B. | 不锈钢餐具属于合金 | |
| C. | 在豆浆中加糖后碗底发现少量晶体状颗粒,这是蛋白质的盐析 | |
| D. | 水的硬度越大,用肥皂洗衣服时效果越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂虽然不参加化学反应,但能增大单位体积内活化分子的数目,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
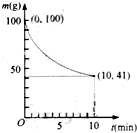 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com