
【题目】环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的![]() 和
和![]() 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黄色)+2H+
(黄色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式:_________________________________。
(2)关于第①步反应,下列说法正确的是________(填序号)。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
【答案】K=![]() AC0.6Fe(OH)3当pH调至4时,c(OH-)=10-10mol·L-1,c(Cr3+)=10-32/c3(OH-)=10-2mol·L-1>10-5mol·L-1,因此Cr3+没有沉淀完全
AC0.6Fe(OH)3当pH调至4时,c(OH-)=10-10mol·L-1,c(Cr3+)=10-32/c3(OH-)=10-2mol·L-1>10-5mol·L-1,因此Cr3+没有沉淀完全
【解析】
(1)因H2O是纯液态物质,其浓度视为常数,故第①步反应的平衡常数表达式为K=![]() ;(2)利用反应①可知,反应正向进行时,溶液pH增大,故pH不变时说明反应达到平衡,A项正确;CrO
;(2)利用反应①可知,反应正向进行时,溶液pH增大,故pH不变时说明反应达到平衡,A项正确;CrO![]() 和Cr2O
和Cr2O![]() 中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(Cr2O
中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(Cr2O![]() )较大,溶液呈橙色,C项正确,故答案为:AC;(3)在第②步反应中Cr2O
)较大,溶液呈橙色,C项正确,故答案为:AC;(3)在第②步反应中Cr2O![]() 被还原为Cr3+,0.1 mol Cr2O
被还原为Cr3+,0.1 mol Cr2O![]() 被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O,故答案为:0.6;(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成,故答案为:Fe(OH)3;(5)当pH调至4时,[OH-]=10-10 mol·L-1,[Cr3+]=10-32/[OH-]3 =10-2 mol·L-1>10-5 mol·L-1,因此Cr3+没有沉淀完全。
被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O,故答案为:0.6;(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成,故答案为:Fe(OH)3;(5)当pH调至4时,[OH-]=10-10 mol·L-1,[Cr3+]=10-32/[OH-]3 =10-2 mol·L-1>10-5 mol·L-1,因此Cr3+没有沉淀完全。


科目:高中化学 来源: 题型:
【题目】根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
A.只有第ⅡA族元素的原子最外层有2个电子
B.L电子层为奇数的所有元素都是非金属
C.第三、四、五、六周期元素的数目分别是18、18、32、32
D.由左至右第8、9、10三列元素中没有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,
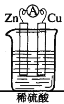
其正极反应式:_________________________;负极反应式: ____________;总反应方程式:_________________。若反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g) + B(g)=== 2C(g)在某段时间内以A的浓度变化表示的化学反应速率为0.5mol L—1 min—1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A. 0.5mol L—1 min—1B. 1 mol L—1 min—1
C. 2 mol L—1 min—1D. 3 mol L—1 min—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成原电池,回答下列问题。
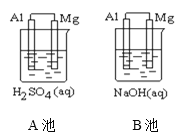
(1)该装置是把___________ 能转化为_________能的装置。
(2)A池中Mg电极是__________(填“正”或“负”)极,其在反应中_____(填“得到”或“失去”)电子,该极发生的反应是__________(填“氧化”或“还原”)反应,其电极反应为________________________,该装置中电流的方向是由_____到 ______。
(3)B池中负极材料是_________,该装置中电子的移动方向是由_____到 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
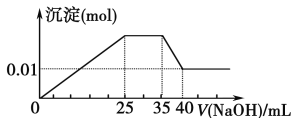
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=1∶1∶2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
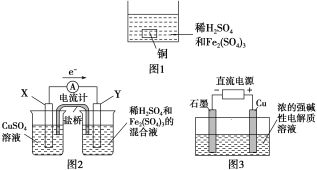
A. 如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO![]() )为0.5 mol/L
)为0.5 mol/L
B. 如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜
C. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D. 如图3所示当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得
B.二氧化硅常温下可与NaOH溶液反应
C.硅酸钠溶液中通入足量的CO2气体后,溶液中不会出现沉淀
D.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com