
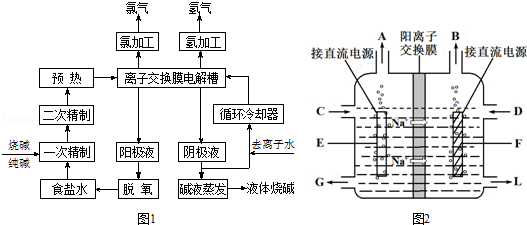
分析 (1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)根据工艺流程图结中用到的原料以及产物,可以知道氯化钠、氢氧化钠是可以循环使用的,故答案为:氯化钠、氢氧化钠;
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:H2;阳极;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl,故答案为:Na2SO3+Cl2+H2O=Na2SO4+2HCl;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,
m(NaOH)=1.516×105kg×32%=4.85×104kg,
则理论上需要电流量为$\frac{4.85×1{0}^{7}g}{1.492g}$=3.252×107A,
则实际上耗电量为1.45×104A×8×300=3.48×107A,
该电解槽的电解效率为$\frac{3.252}{3.48}$×100%=93.45%,
故答案为:93.45%.
点评 本题以氯碱工业为载体,考查学生生化学工艺流程题的解题方法知识,注意电解池的工作原理的灵活应用是关键,难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 |  |  |  | |
| 添加试剂 | 10.0mlFeSO4溶液 | 10.0mlFeSO4溶液+2ml煤油 | 10.0mlFeSO4溶液+1.0铁粉 | 10.0mlFeSO4溶液+ 少量(或几滴)硫酸 |
| 3天内的现象 | 溶液颜色很快变成黄色,并出现棕黄色浑浊 | / | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 gO2中含有的氧分子数为NA | |
| B. | 1 molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2 L H2O中含有的氢原子数为NA | |
| D. | 1 mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NiOOH | B. | Ni(OH)2 | C. | Cd | D. | Cd(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com