
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:分析 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素,X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,则X为C,Y为O;
Z是元素周期表中s区元素,但有未成对电子,则Z是第ⅠA族元素,所以Z为Na;
R的氢化物的沸点比其上周期同族元素氢化物的沸点低,说明R所在主族为第ⅤA、ⅥA、ⅤⅡA中的一族,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,对应的为二氧化锰与浓盐酸反应生成氯气的反应,所以R为Cl,W为Mn,据此答题.
解答 解:X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素,X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,则X为C,Y为O,Z是元素周期表中s区元素,但有未成对电子,则Z是第ⅠA族元素,所以Z为Na,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,说明R所在主族为第ⅤA、ⅥA、ⅤⅡA中的一族,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,对应的为二氧化锰与浓盐酸反应生成氯气的反应,所以R为Cl,W为Mn,
(1)Y为O,与Y同族的短周期元素的基态原子核外有2个未成对电子,R为Cl,R的基态原子核外电子排布式为1s22s22p63s23p5,
故答案为:2;1s22s22p63s23p5;
(2)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以O2-、Na+、Cl-离子半径由小到大的顺序是Na+<O2-<Cl-,元素非金属性越强,第一电离能越大,非金属性O>C>Na,所以C、O、Na的第一电离能由大到小的顺序为O>C>Na,
故答案为:Na+<O2-<Cl-;O>C>Na;
(3)ClO3-离子中,氯原子的价层电子对数为$\frac{7+1}{2}$=4,有一对孤电子对,所以其空间构型是三角锥形,CO2为直线型分子,分子中电荷分布均匀,所以是非极性分子,
故答案为:三角锥形;非极性;
(4)含MnO4-的溶液与浓盐酸反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5C12↑+8H2O;
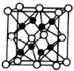
(5)根据晶胞的结构图,空心球数目为$8×\frac{1}{8}+6×\frac{1}{2}$=4,实心球数目为8,对应化合物Na2O的化学式可知,实心球代表钠离子,空心球代表氧离子,根据晶胞结构图,以顶点上的氧离子为例,可以看出氧离子的配位数为 8,以相距一个氧离子最近的所有钠离子为顶点构成的几何体为立方体,
故答案为:8;立方体.
点评 本题考查元素推断、原子核外电子排布、离子半径、第一电离能、分子构型和分子的极性、离子反应方程式、配位数和晶胞的结构等知识,难度不大,答题时注意物质结构的基础知识的灵活运用.


科目:高中化学 来源: 题型:解答题
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 0 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 | |
| B. | 1L 0.1 mol•L-1的Na2SO4溶液中含有0.2 nA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为nA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
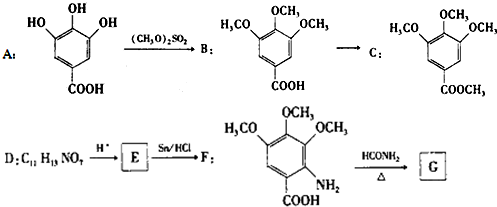
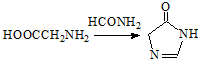
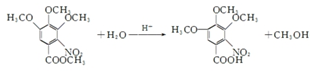 .
.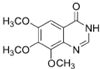 .
.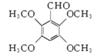 .
.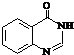 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.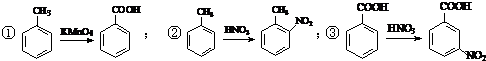 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com