
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
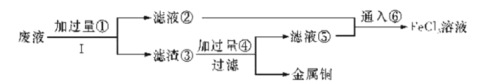
(1)写出下列物质的化学式①___、⑥___。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:_______。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为__色沉淀,此过程所涉及反应的化学方程式为:______、___。
(5)通入⑥发生反应的离子方程式:________。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___(填字母代号)。
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无
【答案】Fe Cl2 过滤 2Fe3++Cu=2Fe2++Cu2+ 红褐 FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl- B
【解析】
从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,由流程可知,①为Fe,发生Fe+CuCl2=Cu+FeCl2,3FeCl3+Fe=3FeCl2,I为过滤,铁粉过量,则滤液②为FeCl2,滤渣③中含Fe、Cu,加过量④为盐酸,过滤得到金属Cu,滤液③中含FeCl2、HCl,为不引入杂质,将铁的化合物全部转化为FeCl3溶液,则通入⑥为氯气,以此来解答。
(1)根据分析,①为Fe,⑥为氯气;
(2)根据分析,步骤I为过滤;
(3)FeCl3溶液与铜箔发生反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:反应生成白色沉淀,后迅速变为灰绿色,接着又转化为红褐色沉淀,此转化的化学方程式为FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)⑥发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(6)A.Fe的还原性大于Cu,所以加入Fe、Cu时Fe先参加反应,当Fe完全反应后、Cu部分反应,则烧杯中有Cu无Fe,故A不符合题意;
B.Fe的还原性大于Cu,所以加入Fe、Cu时Fe先参加反应,如果溶液中有Fe而无铜,则Fe会和铜离子发生置换反应,所以不可能出现有Fe而无Cu现象,故B符合题意;
C.如果铁完全将铁离子还原还剩余,则Cu就不参加反应,所以烧杯中还剩Fe、Cu,故C不符合题意;
D.如果铁离子的量足够多,Fe、Cu完全反应后铁离子还剩余,则烧杯中Cu、Fe都不存在,故D不符合题意;
故答案为B。


科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,某同学为确认其成分,设计并完成了如下实验。由此可知原溶液中,下列有关说法正确的是( )
,某同学为确认其成分,设计并完成了如下实验。由此可知原溶液中,下列有关说法正确的是( )
(![]() )
)
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
C.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
D.要确定原溶液中是否含有![]() ,其操作如下:取少量原溶液于试管中,滴加
,其操作如下:取少量原溶液于试管中,滴加![]() 溶液,紫红色不消失
溶液,紫红色不消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
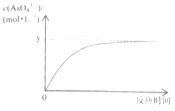
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
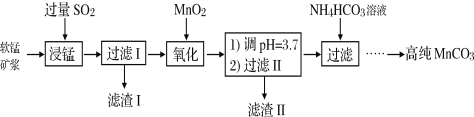
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O
ⅱ:____________________________________________(离子方程式)。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____________(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
(4) “浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
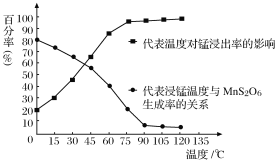
(5).加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______________________________________________________。
Ⅱ.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应式Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
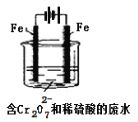
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是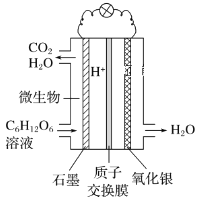
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.每转移4 mol电子,石墨电极产生22.4 L CO2气体
D.每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO23H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
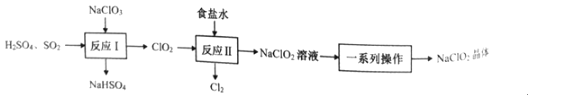
回答下列问题:
(1)NaClO2中氯元素的化合价为__。
(2)“反应Ⅰ”中氧化剂与还原剂的物质的量之比为__。
(3)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和SO42-,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是__。(填标号)
A.①②③④
B.②①③④
C.③①②④
D.③②①④
(4)“一系列操作”为蒸发浓缩、趁热过滤、__、干燥,其中“趁热过滤”应控制的温度范围是__。
(5)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaCIO、NaClO3的混合液。经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
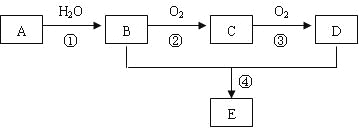
请回答下列问题:
(1)写出A的结构简式___________________________。
(2)B、C分子中的官能团名称分别是________________、______________________。
(3)写出与E具有相同官能团的D的同分异构体的结构简式_______________________。
(4)写出下列反应的化学方程式:
①__________________________________________;反应类型:____________。
④_________________________________________;反应类型:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com