
| A、Fe+4H++NO3-→Fe3++NO↑+2H2O |
| B、3Fe+8H++2 NO3-→3Fe2++2NO↑+4H2O |
| C、3Cu+8H++2 NO3-→3Cu2++2NO↑+4H2O |
| D、3Fe2++4H++NO3-→3Fe3++NO↑+2H2O |


科目:高中化学 来源: 题型:
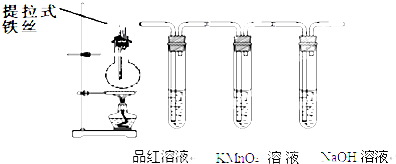
查看答案和解析>>
科目:高中化学 来源: 题型:
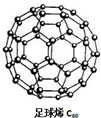 C60可用作储存氢气的材料,结构如图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A、C60、Si60、N60都属于原子晶体 |
| B、C60、Si60、N60分子内共用电子对数目相同 |
| C、由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D、由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N5+有24个电子 |
| B、N5+离子中存在三对未成键的电子对 |
| C、N5+阳离子中存在两个氮氮三键 |
| D、N5+在水中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
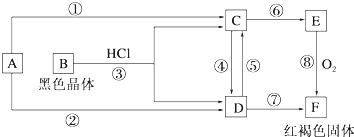
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解质的水溶液中存在电离平衡.
电解质的水溶液中存在电离平衡.| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol?L-1 AgNO3溶液中加入2mL 0.005mol?L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol?L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol?L-1AgNO3溶液. | |
| 步骤4:向步骤1余下的浊液中加入5滴3mol?L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
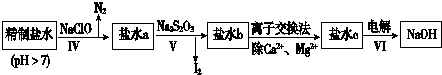
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃甲烷不必事先进行验纯 |
| B、甲烷燃烧放出大量的热,所以是一种很好的气体燃料 |
| C、煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生 |
| D、点燃混有空气的甲烷不一定会爆炸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com