
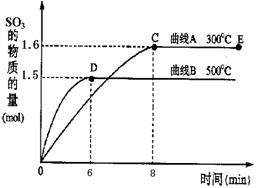
二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2 2SO3。 将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 条件下得到如上所示图象,回答下列问题:
条件下得到如上所示图象,回答下列问题:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ①300℃时,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
①300℃时,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
![]() ②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)= 。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)= 。
![]() ③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
![]() A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
![]() C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
![]()
![]()
![]()
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:
二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:查看答案和解析>>
科目:高中化学 来源:江西省白鹭洲中学2009-2010学年高二3月月考化学试题 题型:022
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(1)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示.根据图示回答下列问题:

①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa.该反应的平衡常数等于________.
②平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”).
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如
:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2
至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ.查看答案和解析>>
科目:高中化学 来源:0110 期中题 题型:填空题
 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题: 

查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是常用的化工原料,工业上常用它来制取硫酸。反应之一是:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6KJ/mol ,回答下面的问题:
2SO3(g) △H=-196.6KJ/mol ,回答下面的问题:
(1) 反应在恒温、恒压下的容积可变的密闭容器中进行,若开始时放入1 mol O2 和2 mol SO2 ,到达平衡时生成1.2 mol SO3 ,则平衡时SO2 的转化率为 ;若再向容器中放入2 mol O2 和4 mol SO2 ,到达平衡后生成的SO3物质的量为 mol。
(2) 某温度下向体积为8L的密闭容器中通入SO2和O2发生反应,上述反应过程中SO2、O2、SO3物质的量变化如下图所示,回答下列问题: ①反应处于平衡状态的时间段是_______ _ 、 。

②该温度下此反应的平衡常数是 。 ③反应进行至20 min时,曲线发生变化的原因可能是_________________(用文字表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com