
| A、该溶液中一定不存在Ba2+和HCO3- | B、取③中滤液加入KSCN,溶液显红色,则原溶液中一定有Fe3+ | C、该溶液中一定存在SO42-和Cl- | D、另取该溶液加少贵NaOH溶液,微热,试管口的湿润红色石蕊试纸不变蓝,则原 溶液中一定不存在NH4+ |


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
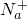 、
、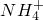 、Fe2+、Fe3+、Ba2+、
、Fe2+、Fe3+、Ba2+、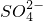 、
、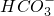 、Cl-.对其进行如下实验:
、Cl-.对其进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
某澄清溶液中可能含有K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、CO![]() 、SO
、SO![]() 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡,CCl4层呈紫红色
③另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。
④另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
(1)写出第②步反应的离子方程式___________________________,由此也可以排除______存在,理由是________________________________(离子方程式表示)
(2)根据上述实验事实确定:该溶液中肯定存在的离子是__________________
(3)还不能确定是否存在的离子是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com