
某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=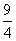 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)(mol·L-1) | 0.010 | 0.020 | 0.020 |
| c(CO2)(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
解析 设平衡时甲中CO2的转化浓度为x mol·L-1,则平衡时H2、CO2、H2O、CO的浓度分别为(0.01-x)mol·L-1、(0.01-x)mol·L-1、x mol·L-1、x mol·L-1,根据平衡常数K=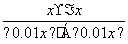 =
=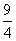 ,解得x=0.006,则甲中H2和CO2的转化率均为
,解得x=0.006,则甲中H2和CO2的转化率均为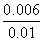 ×100%=60%,由于乙相对于甲增大了c(H2),因此CO2的转化率增大,A项正确;设平衡时丙中H2的转化浓度为y mol·L-1,则平衡时H2、CO2、H2O、CO的浓度分别为(0.02-y)mol·L-1、(0.02-y)mol·L-1、y mol·L-1、y mol·L-1,根据平衡常数K=
×100%=60%,由于乙相对于甲增大了c(H2),因此CO2的转化率增大,A项正确;设平衡时丙中H2的转化浓度为y mol·L-1,则平衡时H2、CO2、H2O、CO的浓度分别为(0.02-y)mol·L-1、(0.02-y)mol·L-1、y mol·L-1、y mol·L-1,根据平衡常数K=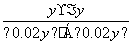 =
=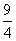 ,解得y=0.012,则丙中H2和CO2的转化率均为
,解得y=0.012,则丙中H2和CO2的转化率均为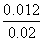 ×100%=60%,B项正确;平衡时甲中c(CO2)=0.01-0.006=0.004(mol·L-1),丙中c(CO2)=0.02-0.012=0.008 (mol·L-1),C项错误;反应开始时,丙中反应物浓度最大,反应速率最快,甲中反应物浓度最小,反应速率最慢,D项正确。
×100%=60%,B项正确;平衡时甲中c(CO2)=0.01-0.006=0.004(mol·L-1),丙中c(CO2)=0.02-0.012=0.008 (mol·L-1),C项错误;反应开始时,丙中反应物浓度最大,反应速率最快,甲中反应物浓度最小,反应速率最慢,D项正确。
答案 C


科目:高中化学 来源: 题型:
下列关于糖类的叙述正确的是( )
A.含有C、H、O三种元素的有机物叫糖类
B.糖类物质均能与银氨溶液在加热时发生反应生成银镜
C.糖类物质都有甜味
D.糖类物质是绿色植物光合作用的产物,是动、植物所需能量的重要来源
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH小于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:I2+2S2O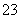 ===S4O
===S4O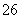 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是______________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是____________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)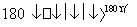 2N2(g)+3H2O(g) ΔH<0
2N2(g)+3H2O(g) ΔH<0
在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为12时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,①、②、③分别表示在不同条件下可逆反应:A(g)+B(g)xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
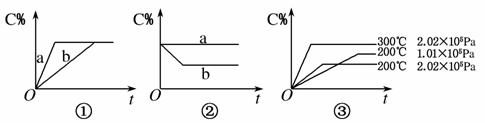
请根据图象回答下列问题:
(1)若图①中两条曲线分别表示有催化剂和无催化剂的情况,则________曲线表示无催化剂时的情况(填字母,下同)。
(2)若图②表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则________曲线表示恒温恒容的情况。
(3)根据图③可以判断该可逆反应的正反应是________热反应(填“吸”或“放”),计量数x的值________(填取值范围);判断的依据分别是____________________________________________________
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述不正确的是( )
A.化学反应是旧键断裂和新键形成的过程
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。

(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:__________________________________________________________
_________________________________________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图①所示的方案,其中焊接在铁闸门上的固体材料R可以采用________。
A.铜 B.钠
C.锌 D.石墨
(3)图②所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属晶体的说法中不正确的是 ( )。
A.金属晶体是一种“巨型分子”
B.“电子气”为所有原子所共有
C.简单立方堆积的空间利用率最低
D.体心立方堆积的空间利用率最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com