
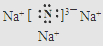 ��
������ A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������Bԭ�ӵ�������������������������Ķ���������㲻�ܳ���8�����ӣ��������ǵ�һ���Ӳ㣬��B��CԪ�أ�C������������Ӧ��ˮ���������⻯�ﷴӦ����һ����X����C��NԪ�أ�X��NH4NO3��E��Aͬ���壬A��B��C������Ԫ�أ�ÿһ����D�����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ������D��ԭ����������7��DΪOԪ�أ�AΪHԪ�أ�A��Eͬ���壬��E��ԭ����������8������E��NaԪ�أ��Դ˽����⣮
��� �⣺A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������Bԭ�ӵ�������������������������Ķ�������㲻�ܳ���8�����ӣ��������ǵ�һ���Ӳ㣬��B��CԪ�أ�
C������������Ӧ��ˮ���������⻯�ﷴӦ����һ����X����C��NԪ�أ�X��NH4NO3��
E��Aͬ���壬A��B��C������Ԫ�أ�ÿһ����D�����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ������D��ԭ����������7��DΪOԪ�أ�AΪHԪ�أ�
A��Eͬ���壬��E��ԭ����������8������E��NaԪ�أ�
��1�������Ϸ�����֪BΪCԪ�أ��ʴ�Ϊ��C��
��2��DΪOԪ�أ�ԭ�Ӻ�����2�����Ӳ㣬�������6�����Ӳ㣬O�����ڱ���λ�ڵڶ����ڣ���16���У��ʴ�Ϊ������16��
��3��C��NԪ�أ�E��NaԪ�أ��γɻ�����ΪNa3N��Ϊ���ӻ��������ʽΪ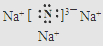 ���ʴ�Ϊ��
���ʴ�Ϊ��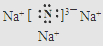 ��
��
��4��E��D�γɵĻ�����Ϊ�����ƺ������ƣ������ƺ������Ʒֱ���ˮ��Ӧ�Ļ�ѧ����ʽΪNa2O+H2O�T2NaOH��2Na2O2+2H2O�T4NaOH+O2����
�ʴ�Ϊ��Na2O+H2O�T2NaOH��2Na2O2+2H2O�T4NaOH+O2����
��5��XΪNH4NO3���������ǿ�������Σ�笠�������ˮ���ʹ��ˮ��Һ�����ԣ���ԭ�������ӷ���ʽ��ʾ�ǣ�NH4++H2O?NH3•H2O+H+��
�ʴ�Ϊ���NH4++H2O?NH3•H2O+H+��
���� ���⿼����Ԫ��λ�ýṹ�����ʵĹ�ϵ����ȷ�ƶ�Ԫ���ǽⱾ��ؼ�����������ˮ�⡢���ʼ�ķ�Ӧ��������ɣ�ע�⣨2����D�����ڱ��е����ж��������壬Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
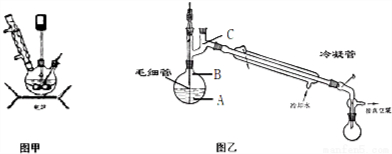 ˮ������Ϊһ����Ҫ�ľ�ϸ����ԭ�ϣ���ũҩ��ҽҩ���л��ϳ����й㷺��;�������ط���ˮ���£��ɷ�Ϊ�����Σ���һ��Ϊ�����Ȼ��Σ��ڶ���Ϊ����ˮ��Σ��ܷ�Ӧ����ʽΪ��CO ��NH2��2+NaClO+2NaOH��H2N-NH2•H2O+NaCl+Na2CO3��
ˮ������Ϊһ����Ҫ�ľ�ϸ����ԭ�ϣ���ũҩ��ҽҩ���л��ϳ����й㷺��;�������ط���ˮ���£��ɷ�Ϊ�����Σ���һ��Ϊ�����Ȼ��Σ��ڶ���Ϊ����ˮ��Σ��ܷ�Ӧ����ʽΪ��CO ��NH2��2+NaClO+2NaOH��H2N-NH2•H2O+NaCl+Na2CO3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
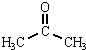 +CH3COOH
+CH3COOH
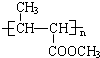 ��һ�ֺϳ����ָ߾����;����������Ⱦ�ٻ�����Ⱦ��ԭ�������ʽϸߣ����ϡ���ɫ��ѧ��ս�ƻ�����Ҫ����ϳ�·�����£�
��һ�ֺϳ����ָ߾����;����������Ⱦ�ٻ�����Ⱦ��ԭ�������ʽϸߣ����ϡ���ɫ��ѧ��ս�ƻ�����Ҫ����ϳ�·�����£�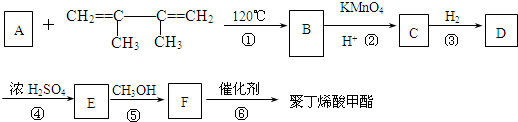
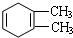 C��
C��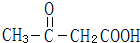
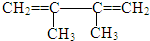 ��ϵͳ����������2��3-����-1��3-����ϩ����Ӧ�����ڼӾ۷�Ӧ���Ӧ���ͣ�
��ϵͳ����������2��3-����-1��3-����ϩ����Ӧ�����ڼӾ۷�Ӧ���Ӧ���ͣ�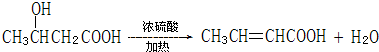 ��Ӧ�ݣ�
��Ӧ�ݣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ��ϡ���ᷴӦ��Ba2++SO42-+H++OH-=BaSO4��+H2O | |
| B�� | ���۵⻯����Һ�ڿ����б�����4I-+O2+2H2O=4OH-+2I2 | |
| C�� | �����������������Fe2O3+6H+=2Fe3++3H2O | |
| D�� | �ð�ˮ����������SO2���壺OH-+SO2=HSO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ϩ��������8���Ҽ���1���м� | |
| B�� | ��SiO2�����У�1��Siԭ�Ӻ�2��Oԭ���γ�2�����ۼ� | |
| C�� | NF3�ķе��NH3�ķе�͵ö࣬����ΪNH3���Ӽ��������NF3ֻ�з��»��� | |
| D�� | NCl3��BC13�����У�����ԭ�Ӷ�����sp3�ӻ� | |
| E�� | �ڡ�����ˮ��ˮ�������������������ı仯�����У����α��ƻ������Ӽ���Ҫ���������������������Ӽ������������Լ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NA �������������3mol �� �� | |
| B�� | 18gˮ�к���NA �Թµ��Ӷ� | |
| C�� | NA �����������к���2mol �м� | |
| D�� | NA ��������̼�����к���2mol �м� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com