
【题目】常温下,向10mL0.1mol·![]() 的HA溶液中逐滴滴入0.1mol·
的HA溶液中逐滴滴入0.1mol·![]() 的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是
的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是
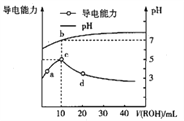
A. ROH在溶液中的电离方程式为![]()
B. c点由![]() 电离出的
电离出的![]() 浓度最小
浓度最小
C. b点存在: ![]()
D. 若升高温度,a、d两点pH增大
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列有关说法错误的是
A. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物
B. 沼气属于生物质能,利用生物质能就是间接利用太阳能
C. 食品中的抗氧化剂对人体无害且均有氧化性
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)常用作食品袋中填充气的是_____,常用作制冷剂的化合物是_____,该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是_______。
(2)铵盐大多在农业上用作化肥。实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
B.定容时俯视刻度线 |
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
实验 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L | 等浓度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com