
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、水解反应NH4++H2O?NH3?H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C、铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D、对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |


科目:高中化学 来源: 题型:
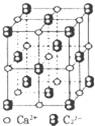 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Ba2+、Cl-、NO3- |
| C、K+、Na+、Cl-、CO32- |
| D、K+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
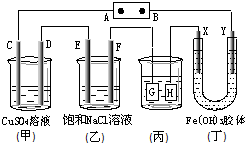 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A、(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
| B、电源B极是正极 |
| C、欲用(丙)装置给铜镀银,G应该是Cu,电镀液选用AgNO3溶液 |
| D、装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:PbCl2>CO2 |
| B、反应中PbCl2被氧化 |
| C、生成22.4L CO2时,转移的电子为2mol |
| D、CO气体只有在高温下才能表现出还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯(C2H4)和苯(C6H6) |
| B、乙醇和丙醇(CH3CH2CH2OH) |
| C、乙醇和乙醚(C2H5OC2H5) |
| D、甲醛( HCHO)和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com