
| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2×10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3×10-33 | 1.4×10-34 |
分析 (1)氮、镓、碳、硅四种元素原子半径最小的是N,位于第二周期第ⅤA主族;C原子序数最小,原子核外有2个电子层,最外层电子数为4;
(2)设镓的另一核素质量数为x,则69×60.1%+x×(1-60.1%)=69.72,据此计算质量数,Ga的质子数=13+18=31,据此书写其同位素符号;
(3)①氢氧化镓与氢氧化铝的性质相似,结合氢氧化铝的电离书写;
②所得的溶液中存在平衡:H++H2O+GaO2-?Ga(OH)3,H++H2O+AlO2-?Al(OH)3,电离平衡常数越小,越容易析出得到沉淀;
(4)根据单质之间的置换反应、气态氢化物的稳定性、最高价含氧酸的酸性、与氢化合的难易、元素周期律等来比较非金属性,以此来解答;
解答 解:(1)氮、镓、碳、硅四种元素原子半径最小的是N,位于第二周期第ⅤA主族;
C原子序数最小,原子核外有2个电子层,最外层电子数为4,核外电子排布式是1s22s22p2;故答案为:第二周期第ⅤA主族;1s22s22p2;
(2)设镓的另一核素质量数为x,则69×60.1%+x×(1-60.1%)=69.72,解得x=71,的质子数=13+18=31,故该同位素符号为3171Ga,
故答案为:3171Ga;
(3)①氢氧化镓与氢氧化铝的性质相似,氢氧化镓的电离方程式为:H++H2O+GaO2-?Ga(OH)3?Ga3++3OH-,
故答案为:H++H2O+GaO2-?Ga(OH)3?Ga3++3OH-;
②所得的溶液中存在平衡:H++H2O+GaO2-?Ga(OH)3,H++H2O+AlO2-?Al(OH)3,Al(OH)3的电离平衡常数更小,故溶液中通入二氧化碳,先析出Al(OH)3沉淀,
故答案为:Al(OH)3;
(4)a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-,说明碳酸的酸性大于硅酸的酸性,则能说明碳的非金属性强于硅,故正确;
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑,该反应是在高温条件下的反应,不能说明C的非金属性强于硅,故错误;
c.氢化物越稳定,其非金属性越强,SiH4$\stackrel{500℃}{→}$Si+2H2;CH4$\stackrel{>1000℃}{→}$C+2H2,则能说明碳的非金属性强于硅,故正确;
d.Si+O2$\stackrel{900℃}{→}$SiO2;C+O2$\stackrel{300℃}{→}$CO2,不能说明C的非金属性强于硅,故错误;
故答案为:ac.
点评 本题考查结构性质位置关系应用、常用化学用语、电离平衡常数应用,难度中等,(2)中注意根据氢氧化铝性质进行解答.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
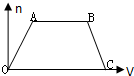 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,图中AB段表示的离子方程式先后顺序正确的是( )| A. | ③① | B. | ②⑤ | C. | ⑤④ | D. | ④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与碳酸钠溶液混合:Ca2++CO32-→CaCO3↓ | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4 溶液,刚好沉淀完全:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-→3BaSO4↓+2NO↑+H2O | |
| D. | 碳酸氢钠溶液中加入过量的氢氧化钙溶液:2HCO3-+Ca2++2OH-→CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①生成HIO3时发生的反应为:I2+5 Cl2+6 H2O=2 HIO3+10 HCl | |
| B. | 实验②中当CCl4层变成红棕色时可通过萃取分液的方法获得Br2的CCl4溶液 | |
| C. | 根据上述实验可得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2>Br2>I2 | |
| D. | 根据上述实验可得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:HBrO3>Cl2>HIO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com