
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 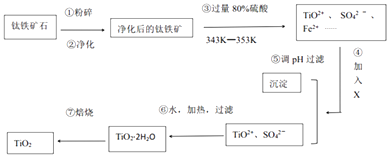
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
【答案】
(1)Al2O3+2OH﹣=2AlO2﹣+H2O;A;除去亚铁离子;TiOSO4+3H2O=TiO22H2O↓+H2SO4
(2)TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti);碳单质会与阳极产生的氧气反应而不断减少
【解析】解:钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH﹣=2AlO2﹣+H2O、SiO2+2OH﹣=SiO32﹣+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K﹣353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4 , 加入X并调节溶液的pH得到沉淀和TiO2+、SO42﹣ , 说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42﹣加热、过滤得到TiO2.2H2O,焙烧得到TiO2;(1)(i)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH﹣=2AlO2﹣+H2O,
故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O;(ii)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,故选A;(iii)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,故答案为:除去亚铁离子;(iv)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO22H2O↓+H2SO4 ,
故答案为:TiOSO4+3H2O=TiO22H2O↓+H2SO4;(2)(i)TiO2与Cl2、C反应得到TiCl4 , 同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁,则生成四氯化钛的反应方程式为TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO,
故答案为:TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;(ii)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti),
故答案为:TiO2+4e﹣=Ti+2O2﹣(或Ti4++4e﹣=Ti);(iii)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,
故答案为:碳单质会与阳极产生的氧气反应而不断减少.
钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH﹣=2AlO2﹣+H2O、
SiO2+2OH﹣=SiO32﹣+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K﹣353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4 , 加入X并调节溶液的pH得到沉淀和TiO2+、SO42﹣ , 说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42﹣加热、过滤得到TiO2.2H2O,焙烧得到TiO2;(1)(i)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;(ii)④X应该具有强氧化性,且不能引进杂质;(iii)④⑤两步的目的是除去亚铁离子;(iv)⑥中TiO2+水解生成TiO2.2H2O;(2)(i)TiO2与Cl2、C反应得到TiCl4 , 同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁;(ii)阴极上得电子反应还原反应生成金属钛;(iii)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1molL﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2molL﹣1和0.1molL﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,PH=12的氨水与pH=2的H2SO4溶液等体积混合后,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A在一定条件下可以按图进行转化: 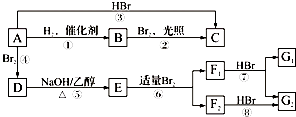 已知D为
已知D为 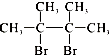 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答:
(1)框图中属于取代反应的是(填序号);B完全燃烧后生成的CO2和水的质量比为 .
(2)A的结构简式是;G1的结构简式是 .
(3)写出E在一定条件下生成高聚物的化学方程式:
(4)已知B可在碱性条件下和O2构建成燃料电池,写出负极的电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次酸雨的分析数据如下:c(NH ![]() )=2.0×10﹣4molL﹣1 , c(Na+)=1.9×10﹣4molL﹣1 , c(SO
)=2.0×10﹣4molL﹣1 , c(Na+)=1.9×10﹣4molL﹣1 , c(SO ![]() )=2.8×10﹣4molL﹣1 , c(Cl﹣)=6.0×10﹣4molL﹣1 , c(NO
)=2.8×10﹣4molL﹣1 , c(Cl﹣)=6.0×10﹣4molL﹣1 , c(NO ![]() )=2.3×10﹣4molL﹣1 . 则此次酸雨的pH约为( )
)=2.3×10﹣4molL﹣1 . 则此次酸雨的pH约为( )
A.3
B.4
C.5
D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写不正确的是( )
A. 大理石与盐酸反应 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
B. 氯化铁溶液中插入铜片:2Fe3++Cu══2Fe2++Cu2+
C. 碳酸氢钠溶液与氢氧化钠反应: OH-+HCO![]() ══CO32-+H2O
══CO32-+H2O
D. 将铁片放入硫酸铁溶液中:Fe + Fe3+ ==2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,请回答下列问题。
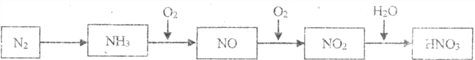
(1)实验室常用加热氯化铵和氢氧化钙的固体混合物制取氨气,该反应的化学方程式是________________________。
(2)实验室检验氨气时,可选用的试剂是________(填选项)。
a.湿润的蓝色石蕊试纸 b.湿润的红色石蕊试纸 c.浓盐酸
(3)氨气催化氧化的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( ) 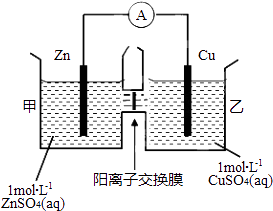
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42﹣)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com