
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=+1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol |
分析 已知:①N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,根据盖斯定律,②-①×$\frac{1}{2}$可得N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol,结合热化学方程式的书写原则进行判断.
解答 解:已知:①N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,根据盖斯定律,②-①×$\frac{1}{2}$可得N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol,
A.反应热与化学计量数成正比,则2mol N2H4完全反应放热的热量为1 076.7 kJ,故A错误;
B.2mol N2H4完全反应放热的热量为1 076.7 kJ,故B错误;
C.该反应为放热反应,焓变应该为负值,故C错误;
D.根据分析可知,肼跟N2O4反应的热化学方程式为:N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol,故D正确;
故选D.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
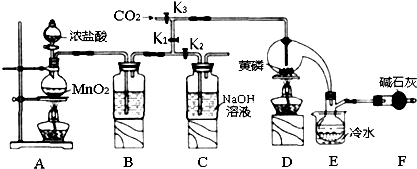
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
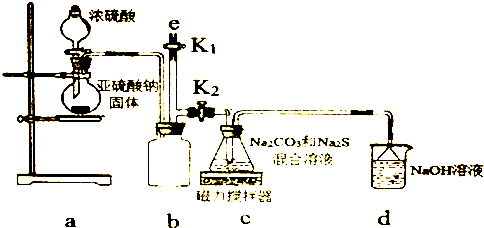
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 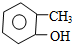 邻甲基苯酚 邻甲基苯酚 | |
| D. | 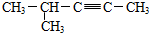 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com