
分析 (1)在化合物中非金属性强的元素显负价,非金属性弱的元素显正价,氮元素的非金属性比碳强,且化合物中各元素正负化合价的代数和为0,在反应NaCN+Na2S2O3=NaSCN+Na2SO3中,碳从+2价升为+4价,硫从+2价变为-2价和+4价,据此可计算去反应掉1molNaCN,反应中转移电子的物质的量为;
(2)NaCN用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明二者反应生成氨气、和碳酸氢钠;
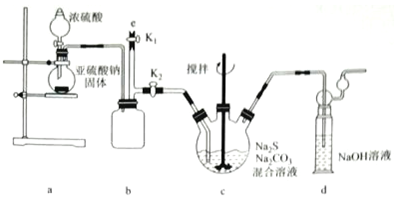
(3)a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气.
①由仪器结构特征,b装置为安全瓶,防止溶液倒吸;d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,另外空气中的氧气还可以氧化亚硫酸钠生成硫酸钠;
②实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;
【实验二】③标准AgNO3溶液是显酸性,应选择酸式滴定管盛放;Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;
④计算消耗硝酸银物质的量,再根据方程式Ag++2CN-=[Ag(CN)2]-计算出氰化钠的含量与废水中氰化钠的最高排放标准为0.50mg/L比较判断是否符合排放标准
解答 解:(1)在化合物NaCN中,Na元素显+1价,N元素显-3价,根据正负化合价代数和为0,可知碳元素的化合价为+2价,在反应NaCN+Na2S2O3=NaSCN+Na2SO3中,碳从+2价升为+4价,硫从+2价变为-2价和+4价,所以去掉1molNaCN时,反应中转移电子的物质的量为4mol,故答案为:+2;4mol;
(2)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,离子反应为:CN-+H2O2+H2O═HCO3-+NH3↑,
故答案为:CN-+H2O2+H2O═HCO3-+NH3↑;
(3)a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气.
①由仪器结构特征,可知b装置为安全瓶,防止倒吸,d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,再考虑到装置中空气中的氧气氧化亚硫酸钠可生成硫酸钠,
故答案为:安全瓶,防止倒吸;Na2SO3、Na2SO4;
②实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,再关闭K2打开K1,防止拆除装置时污染空气,
故答案为:NaOH溶液;
【实验二】③选择酸式滴定管盛放标准AgNO3溶液;Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,
故答案为:酸式滴定管;滴入最后一滴硝酸银溶液,出现淡黄色沉淀;
④消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为$\frac{1.47×1{0}^{-2}mg}{0.0200L}$=0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准,
故答案为:否;消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量$\frac{1.47×1{0}^{-2}mg}{0.0200L}$=0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准.
点评 本题考查物质制备实验、物质含量测定等,题目综合性较强,关键是对原理的理解及实验操作的规范性,注意制备中渗入环保意识,熟练掌握元素化合物知识与实验制备基本原则,题目难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2与水反应生成盐酸和次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向氯化铝溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 用醋酸除水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②⑤③① | B. | ⑤②④①③ | C. | ②⑤④③① | D. | ④①②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 24 | C. | 20 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化镁溶液加热蒸干:MgCl2+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ MgCl2•6H2O | |
| B. | 碘水中通适量SO2:I2+SO2+H2O═4H++2I-+SO42- | |
| C. | 氯化铝溶液加入足量氨水:A13++4NH3•H2O=A1O2-+4NH4++2H2O | |
| D. | 氯化铁溶液滴加少量氢硫酸:2Fe3++H2S=2Fe2++S↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com