
| A.酒精灯不用时必须盖上灯帽 |
| B.给试管中的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 |
| C.给试管中的液体加热时,试管中不要对着自已和别人 |
| D.用氢气还原氧化铜时,应先通一会氢气,然后再加热氧化铜 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 实 验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的I2 | 加热分解MgCl2.6H2O得到纯净的MgCl2 | 配制100 mL 0.1000 mol·L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 | 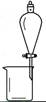 | 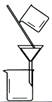 | 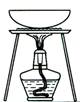 |  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.烧碱---爆炸品 | B.浓硫酸---剧毒品 | C.汽油---腐蚀品 | D.酒精---易燃品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
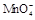 在酸性环境下的还原产物是
在酸性环境下的还原产物是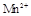 ;②草酸是二元弱酸。
;②草酸是二元弱酸。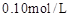 的草酸溶液
的草酸溶液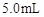 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |  固体 固体 | 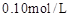 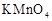 溶液 溶液 | 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
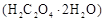 样品
样品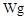 ;配制成
;配制成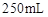 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答: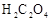 溶液与酸性
溶液与酸性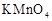 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.未冷却即转移、定容 | B.未洗涤烧杯和玻璃棒 |
| C.定容时仰视刻度线观察液面 | D.容量瓶中原来含有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.H2SO4 | B.NaOH | C.NaCl | D.HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②③④ | C.①③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
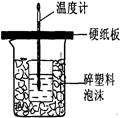
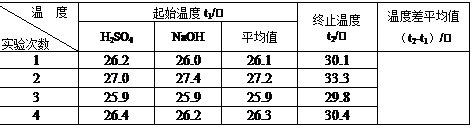
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 在稀AgNO3溶液中加入少量NaCl溶液产生白色沉淀后再加入适量NaI溶液,出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
| B | 分别向2支试管中加入等体积等浓度的Na2S2O3溶液,再向其中分别加入等体积不同浓度的H2SO4溶液 | 研究反应物浓度对化学反应速率的影响 |
| C | 向混有亚硫酸钠的硫酸钠溶液中加入适量的BaCl2溶液 | 检验SO42-存在 |
| D | 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液 | 制备Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com