
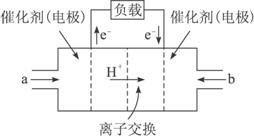
A.左电极为电池的负极,a处加入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH3OH+H2O-4e-![]() CO2↑+6H+
CO2↑+6H+
D.正极反应式为:2H++2e-====H2↑
科目:高中化学 来源:山东省日照市2011届高三一模理综化学试题 题型:058
碳和碳的化合物在生产生活实际中应用广泛.运用化学反应原理研究碳的氧化物的性质具有重要意义.
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数K=4.7×10-8.写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式________;
(2)下图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图.电池总反应为2CH3OH+3O2![]() 2CO2+4H2O.该装置放电时________(填“a”或“b”)为电池的负极,其电极反应式为________;
2CO2+4H2O.该装置放电时________(填“a”或“b”)为电池的负极,其电极反应式为________;
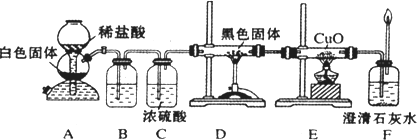
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置.
已知
:C+H2O CO+H2 CO+H2O
CO+H2 CO+H2O CO2+H2
CO2+H2 C+CO2
C+CO2试回答下列问题:
①装置B中最适宜的试剂是________,必须用装置C吸收气体中的水蒸气的理由是________;
②根据该实验中的________现象,可证明
CO具有还原性;③若要根据装置
F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置与________之间(填字母标号)连接下图中的________装置(选填序号).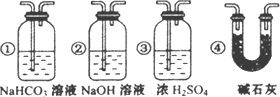
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
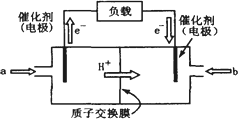
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O22CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2OCO+H2 CO + H2O
CO2 + H2 C + CO2
2CO
试回答下列问题:
① 装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
② 根据该实验中的 现象,可证明CO具有还原性;
③ 若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省如皋中学高二10月阶段练习化学试卷(带解析) 题型:填空题
(16分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:____________________________________。
⑵下图是某笔记本电脑用甲醇燃料电池的结构示意图。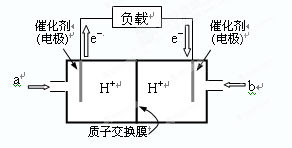
放电时甲醇应从______处通入(填“a”或“b”),电池内部H+向_____(填“左”或“右”)移动。写出电池负极的电极反应式:_______________________________。
⑶由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | a | 945 |
 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值:_______________。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值:_______________。查看答案和解析>>
科目:高中化学 来源:2014届江苏省高二10月阶段练习化学试卷(解析版) 题型:填空题
(16分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:____________________________________。
⑵下图是某笔记本电脑用甲醇燃料电池的结构示意图。
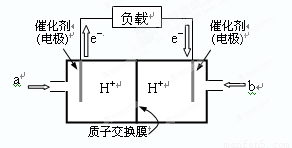
放电时甲醇应从______处通入(填“a”或“b”),电池内部H+向_____(填“左”或“右”)移动。写出电池负极的电极反应式:_______________________________。
⑶由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
a |
945 |
已知反应N2(g)+3H2(g) 2NH3(g)
△H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
2NH3(g)
△H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
⑷依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H =________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com