
| A、F2 |
| B、金刚石 |
| C、Na2O |
| D、NH3 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
| A、①③④ | B、②⑥⑦ |
| C、③④⑤ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | KOH | BaCl2 |
| pH变化 | 减小 | 增大 | 增大 | 不变 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质失去电子数越多,物质的还原性越强 |
| B、导电的不一定是电解质,电解质不一定导电 |
| C、得到电子的物质是还原剂 |
| D、还原剂反应后得到是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
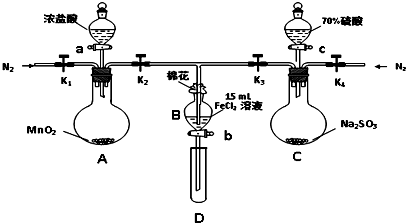
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
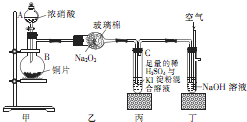 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | 淡黄色固体变白色 | Na2O2+2NO2═2NaNO3 | |
| 丙 | 氧化性 |
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测溶液于试管A中,加入几滴 |
|
| 步骤② | |
|
| 步骤③ | 另取少量待测溶液于试管C中,加入足量氯水,再加入四氯化碳,静置后观察颜色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com