
| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯(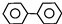 )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |
分析 A、分子式为C7H8O的芳香化合物可能为醇和醚,也可能为酚;
B、甲苯苯环上有3种H原子,含3个碳原子的烷基取代有正丙基、异丙基,据此计算判断;
C、丙烷中的氢原子有2种,据此判断一氯代物的种类;根据一氯丙烷的结构来分析二氯丙烷的种类;
D、根据分子中等效H原子判断一氯代物异构体数,分子中由几种H原子,其一氯代物就有几种异构体;联苯( )二氯代物可以取代同一苯环上的氢原子,可以取代不同苯环上的氢原子,定其中1个氯原子位置,移动另一氯原子,书写判断.
)二氯代物可以取代同一苯环上的氢原子,可以取代不同苯环上的氢原子,定其中1个氯原子位置,移动另一氯原子,书写判断.
解答 解:A、分子式为C7H8O的芳香化合物可能为醇和醚,也可能为酚,若为醇,则-OH连在苯环侧链上,结构有1种;若为醚,则结构有1种;若为酚,则-OH直接连在苯环上,根据-OH与甲基的相对位置有邻、间、对3种,故结构有3种,故同分异构体共有5种,故A错误;
B、甲苯苯环上有3种H原子,含3个碳原子的烷基有正丙基、异丙基两种,所以甲苯苯环上的一个氢原子被含3个碳原子的烷基取代有3×2=6种,故B正确;
C、丙烷分子周由2种氢原子,其一氯代物有2种;丙烷的二氯代物,若取代相同的碳原子的氢原子,有1,1-二氯丙烷,2,2-二氯丙烷两种,若取代不同碳原子上的氢原子,有1,2-二氯丙烷、1,3-二氯丙烷两种,故丙烷的二氯代物有4种,故C正确;
D、联苯( )的分子中含有3中氢原子,其一氯代物有3种;联苯(
)的分子中含有3中氢原子,其一氯代物有3种;联苯( )二氯代物,若取代同一苯环上的氢原子,可以发生在如图
)二氯代物,若取代同一苯环上的氢原子,可以发生在如图 所示的取代位置,1、2(与4、5相同)号位置,1、3(与3、5相同)号位置,1、4(与2、5相同)号位置,1、5号位置,2、3(与3、4相同)号位置,2、4号位置,有6种;若取代不同苯环上的氢原子,有如图所示的6种
所示的取代位置,1、2(与4、5相同)号位置,1、3(与3、5相同)号位置,1、4(与2、5相同)号位置,1、5号位置,2、3(与3、4相同)号位置,2、4号位置,有6种;若取代不同苯环上的氢原子,有如图所示的6种 ,故其二氯代物有12种,故D正确.
,故其二氯代物有12种,故D正确.
故选A.
点评 本题考查同分异构体的书写与判断,难度中等,注意一氯代物利用等效氢判断,二元取代采取定一移一法,注意重复、漏写.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
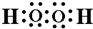 含有的化学键类型有BC(填序号).
含有的化学键类型有BC(填序号). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol C6H14分子中共价键总数为20NA | |
| B. | 1mol乙基(-CH2CH3)电子总数17NA | |
| C. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为4NA | |
| D. | 标准状况下,22.4L甲醇的分子数中所含羟基数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸 | |
| C. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 碳酸、亚硫酸和次氯酸都是不稳定性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
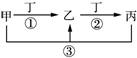 甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )| A. | 若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 | |
| B. | 若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | 若甲、乙、丙的溶液显碱性,则丙可能可以作为医疗上治疗胃酸过多症的药剂 | |
| D. | 若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84 g NaHCO3晶体中含有NA个CO32- | |
| B. | 室温下,14.0 g乙烯和丁烯的混合气体中含有C-H键数目为2.0NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| D. | 78 g Na2O2与足量的CO2反应,电子转移个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一氯代烷烃,随C原子数的增多,密度依次增大 | |
| B. | 常温下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 饱和一元羧酸,随C原子数的增多,酸性逐渐减弱 | |
| D. | 邻-二甲苯、间-二甲苯,对-二甲苯的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com