
| A. | 钠 | B. | 铁 | C. | 银 | D. | 金 |
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,
物理分离法:Pt、Au用物理分离的方法制得.
解答 解:A.钠性质活泼用电解法制取,故A不选;
B.铁性质较活泼用热还原反应制取,故B选;
C.银性质稳定用热分解氧化物法制取,故C不选;
D.金性质不活泼,用物理分离的方法制得,故D不选;
故选:B.
点评 本题考查金属冶炼的一般方法和原理,明确金属的活泼性是解题关键,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i |
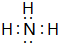 .
.
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应的反应物总能量低于生成物总能量 | |
| B. | 绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 | |
| C. | 电力属于一次能源 | |
| D. | 物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
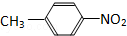 和
和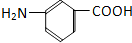
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com