
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是

A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下,N得到P的化学方程式为 FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
D
【解析】
试题分析:8.34gFeS04·7H20的物质的量是0.03mol。其中硫酸亚铁的物质的量是0.03mol,水的物质的量是0.21mol。A、温度为78℃时固体质量是6.72g,减少水的质量是8.34-6.72=1.62g,物质的量是0.09mol,所以硫酸亚铁与水的物质的量之比是0.03:0.12=1:4,所以物质M的化学式为FeSO4?4 H20,错误;B、温度为l59℃时固体的质量是5.10g,固体质量减少8.34-5.10=3.24g,说明减少水的物质的量是0.18mol,则硫酸亚铁与水的物质的量之比是0.03:0.03=1:1,该固体物质的化学式为FeSO4?H20,错误;C、在隔绝空气条件下,N得到P过程中固体质量减少5.10-4.56=0.54g,应是FeSO4?H20全部失去结晶水的过程,错误;D、380℃时所得的样品P的质量是4.56g,恰好是硫酸亚铁的质量,隔绝空气加热至650℃,得到一种固体物质的质量是2.40g,若Q的化学式是Fe2O3,则其物质的量为0.015mol,质量恰好为2.4g,根据氧化还原反应理论,铁元素的化合价升高,则硫元素的化合价降低,所以生成的两种无色气体是二氧化硫与三氧化硫,符合此图,正确,答案选D。
考点:考查对图像的分析,物质化学式的计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ = Cu + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.8 | 6.3 | 5.2 |
完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1 实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1: ;组合2:
;……(用化学式表示)
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:选择题
生活中的问题常涉及到化学知识,下列叙述中正确的是
A.硫酸钡是一种难溶于水和酸的盐,可用作X光透视肠胃的药剂
B.使用明矾可以对水进行消毒、杀菌
C.铁制品在干燥的空气中易生锈
D.棉花、蚕丝和人造丝的主要成分是纤维素
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市三校高三上第一次联考化学试卷(解析版) 题型:选择题
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为
A.29 :8 :13 B.22 :1 :14 C.13 :8 :29 D.26 :15 :57
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:填空题
(12分)以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:
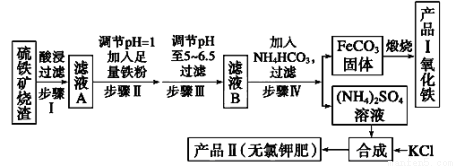

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是_______________________ _______。
(2)滤液B中加入NH4HCO3溶液的离子方程式 。
(3)煅烧FeCO3生成产品I的化学反应方程式为___________ __________________。
(4)已知几种盐的溶解度随温度变化的曲线如如图所示,产品Ⅱ的化学式为 ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 、趁热过滤、洗涤、干燥。
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是_______________,进一步提纯产品Ⅱ的方法是________________;
(6)步骤Ⅲ中可选用______________(填序号)试剂调节溶液的pH。
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:选择题
一定能在下列溶液中大量共存的离子组是
①含有大量Al3+的溶液中:Na+、NH4+、SO42—、Cl-
②加入Al能放出H2的溶液中:Cl-、HCO3—、SO42—、NH4+
③含有大量Fe3+的溶液中:Na+、Mg2+、NO3—、SCN-
④在含有大量AlO2—的溶液中:NH4+、Na+、Cl-、H+
⑤由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3—
A.①② B.①③⑤ C.① D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:选择题
利用实验器材(规格和数量不限)能完成相应实验的一项是
选项 | 实验器材(省略夹持装置) | 相应实验 l |
A | 三脚架、泥三角、坩埚、坩埚钳 | 用CuSO4 |
B | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用浓盐酸配制0.1mol·L-1的HCl溶液 |
C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一学期月考化学试卷(解析版) 题型:选择题
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1Ba(OH)2溶液300 mL(忽略溶液体积变化),反应后溶液中SO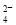 的物质的量浓度为( )
的物质的量浓度为( )
A.0.4 mol·L-1B.0.3mol·L-1C.0.2 mol·L-1D.0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省苏州市高三9月学情调研化学试卷(解析版) 题型:选择题
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
A |
| NaOH | NaHCO3 | Na2CO3 | CO2 |
B | AlCl3 | NaAlO2 | Al(OH)3 | NaOH | |
C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 | |
D | C | CO | CO2 | O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com